Publié le 27 mar 2020Lecture 7 min
Dermatite atopique, une recherche thérapeutique très active
D. CARO, Boulogne-Billancourt
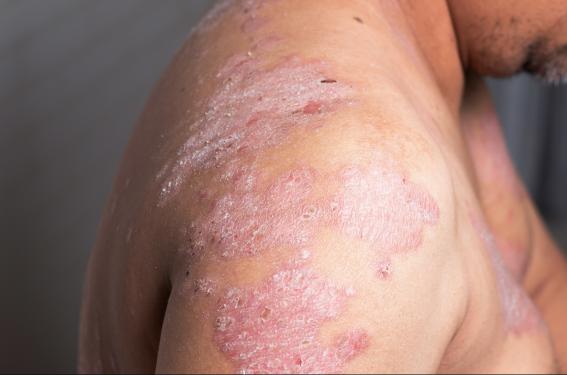
Très fréquente, la dermatite atopique touche environ 20 % des enfants et 10 % des adultes à travers le monde.
Responsable d’érythème, de démangeaisons et de lésions cutanées suintantes, indurées et parfois croûteuses, elle affecte la qualité de vie des patients(1,2). Les progrès dans la compréhension de la physiopathologie de la maladie ont permis la mise au point d’une première biothérapie, le dupilumab, un inhibiteur de l’IL-13/IL-4(3). D’autres molécules sont en développement, dont des inhibiteurs de la Janus Kinase (JAK) actifs par voie orale. Des inhibiteurs de l’IL-1 et de l’IL-13 sont également à l’étude. De nombreux résultats concernant ces traitements prometteurs ont été communiqués au 28e congrès de l’EADV.
Le blocage de JAK1 permet de moduler de multiples cytokines impliquées dans la physiopathologie de la dermatite atopique (DA) dont l’IL-4, l’IL-13, l’IL-31 et l’INF gamma ; observation qui a conduit au développement de cette nouvelle classe thérapeutique dans la DA modérée à sévère. De nouveaux résultats concernant le baricitinib, l’abrocitinib et l’upadacitinib viennent d’être communiqués.
Le baricitinib (BARI) est un inhibiteur sélectif de JAK1 et JAK2. Les études de phase 3, BREEZE-AD1 et BREEZE-AD2 ont montré l’efficacité du BARI en monothérapie chez des patients atteints de dermatite atopique modérée à sévère(4). BREEZE-AD7 a évalué l’efficacité de BARI en association avec un dermocorticoïde d’activité légère à modérée (DC)(5). 329 adultes avec une DA modérée à sévère ont été randomisés en 3 groupes qui recevaient : placebo + DC, BARI 2 mg + DC et BARI 4 mg + DC, une fois par jour, pendant 16 semaines.
À 16 semaines, 30,6 % des patients du groupe BARI 4 mg avaient une réponse complète ou quasi complète (IGA 0 ou 1) contre 14,7 % dans le groupe placebo (p < 0,01), critère principal de l’étude. Le pourcentage de patients dont le score EASI était amélioré par rapport à l’inclusion était significativement plus important dans les groupes BARI 2 mg et 4 mg que dans le groupe placebo (67,2 % avec BARI 4 mg [p < 0,01] et de 58,2 % avec BARI 2 mg [p < 0,05]), de même que la proportion de patients atteignant un EASI 75 (respectivement 47,7 % [p < 0,01], 43,1 % [p < 0,01] et 22,9 %). Le traitement actif était supérieur au placebo sur les démangeaisons (p < 0,01), la douleur cutanée (p < 0,01) et la qualité de vie. L’index DLQI était abaissé de 8,89 points dans le groupe BARI 4 mg (p < 0,01), de 7,5 points dans le groupe BARI 2 mg (p < 0,05).
Enfin, les patients des groupes BARI ont utilisé moins de dermocorticoïdes que ceux du groupe placebo : respectivement 32,9 (p < 0,01), 25,3 (p < 0,05) et 17,4 jours sans DC en 16 semaines.
Concernant la tolérance, 57,7 % des patients BARI 4 mg, 56 % des patients BARI 2 mg et 38 % des témoins ont signalé un effet adverse (rhinopharyngite, folliculite, infection respiratoire haute, herpès…) ; il y a eu 2,7 % d’interruptions du traitement dues à un effet indésirable dans le groupe BARI 4 mg, 0,9 % dans le groupe BARI 2 mg et 0 % avec le placebo. Il n’y a pas eu de retentissement des traitements sur la numération formule sanguine.
Intérêt confirmé des inhibiteurs de JAK1
Les résultats de l’étude de phase 3 (JADE MONO-1) évaluant l’efficacité et la tolérance de l’abrocitinib (ABRO) confirment l’intérêt des inhibiteurs de JAK1(6). Cet essai a comparé 100 mg d’ABRO, 200 mg d’ABRO et un placebo, administré une fois par jour pendant 12 semaines, chez 387 patients âgés de 12 ans et plus atteints de DA modérée à sévère. Une phase d’extension à long terme (LTS) est prévue à l’issue de cette première période.
À 12 semaines, les deux doses d’ABRO étaient significativement supérieures au placebo sur les critères principaux : IGA de 0 ou 1, ou amélioration d’au moins 2 points, atteinte par 43,8 % des patients du groupe ABRO 200 mg, 23,7 % du groupe ABRO 100 mg et 7,9 % avec le placebo ; EASI-75 obtenu par respectivement 62,5 %, 39,7 % et 11,8 % des patients.
Le traitement quelle que soit la dose faisait également mieux que le placebo concernant les critères secondaires. Respectivement 57,2 %, 37,7 % et 15,3 % des patients avaient une amélioration de 4 points ou plus de leur score de démangeaisons. Et 38,6 %, 18,6 % et 5,3 % des patients avaient atteint un EASI-90.
Concernant la tolérance, les effets adverses le plus souvent rapportés avec 200 mg et 100 mg d’ABRO ont été les nausées (20 % et 9 %), les céphalées (9,7 % et 7,7 %), les rhinopharyngites (11,4 % et 14,7 %), alor s qu’avec le placebo c’était les problèmes cutanés (16,9 %). Il y a eu 3,2 % d’effets adverses sérieux dans les groupes 200 mg et 100 mg d’ABRO et 1,9 % dans le groupe placebo. 5,8 % des patients ont arrêté le traitement pour effet indésirable dans les groupes ABRO et 9,1 % dans le groupe placebo.
Troisième inhibiteur de JAK1 en développement, l’upadacitinib (UPA) a fait l’objet d’une étude de phase 2 b dont les résultats viennent d’être présentés(7). En tout, 166 patients atteints de DA modérée à sévère ont été randomisés dans 4 groupes : UPA 7,5 mg, UPA 15 mg ou UPA 30 mg ou placebo. Le traitement était pris 1 fois par jour pendant 16 semaines. Les 3 doses d’UPA obtenaient significativement de meilleurs résultats que le placebo sur le critère principal (EASI-75), avec respectivement 90,5 %, 66,7 %, 45,2 % vs 22 % des patients ayant atteint l’objectif ; la dose de 30 mg faisait mieux que celle de 15 mg et de 7,5 mg. Les patients recevant les doses de 30 mg ou 15 mg atteignaient un EASI75 plus rapidement que ceux du groupe 7,5 mg, en respectivement 29, 54 et 115 jours.
Le traitement était également efficace sur les démangeaisons avec une réduction d’au moins 4 points le score du prurit chez 97,4 % du groupe 30 mg, 85,3 % avec 15 mg, 68,3 % avec 7,5 mg et 27 % avec le placebo, la différence est significative pour les 3 doses. Les effets adverses les plus fréquent s (comparés au placebo) étaient les infections respiratoires hautes (16,7 %, 11,9 %, 11,9 % vs 10,0 %) et l’exacerbation de la DA (16,7 %, 7,1 %, 11,9 % vs 7,5 %).
Le blocage de l’IL-1 ou de l’IL-13
À côté des inhibiteurs de JAK1, d’autres pistes thérapeutiques sont explorées. Tel est le cas du bermekimab, un anticorps monoclonal ciblant l’IL-1 alpha. En effet, on sait que la voie Th1 joue un rôle dans la DA chronique de l’adulte. Sous l’influence de diverses cytokines dont l’IL-17A et l’IL-17C, les kératinocytes augmentent la libération d’IL-1 alpha. Cette dernière est responsable du recrutement des leucocytes qui conduit à l’inflammation, elle altère la fonction barrière par le biais des métalloprotéases, elle potentialise les nocicepteurs responsables de démangeaisons et elle active l’endothélium vasculaire(8).
Une étude ouverte de phase 2 a évalué l’efficacité et la tolérance de différentes doses bermekimab (BER) 200 mg/semaine pendant 4 semaines (10 patients), ou 400 mg/semaine pendant 8 semaines (28 patients)(9). Les patients du groupe 400 mg ont réduit de 80 % leur EASI par rapport à l’inclusion (p < 0,001), contre 20 % avec la dose de 200 mg à 4 semaines. Environ 3 patients sur 4 du groupe 400 mg ont atteint un EASI-75 à 8 semaines. Le SCORAD a été réduit près de 70 % par rapport à l’inclusion (p < 0.001). Le bénéfice de la dose 400 mg était significatif dès la semaine 4 avec une amélioration de 35 % de l’IGA et une réduction de 1,20 de cet index (p < 0,0001).
Cet essai a également montré le bénéfice de BER 400 mg sur l’anxiété et la dépression évaluée sur le score HADS : 50 % d’amélioration à S4 et 72 % à S8 pour l’anxiété et 38 % à S4 et 63 % à S8 pour la dépression (différence hautement significative par rapport à l’inclusion p < 0,0001). Le traitement améliorait également la qualité de vie (réduction de 70 % du DLQI à la S8 p < 0,001). Enfin, les démangeaisons ont diminué de plus de 70 % et la douleur cutanée de plus de 80 %.
Sur le plan de la tolérance, 3 patients ont signalé les réactions au site d’injection, 2 des difficultés respiratoires (sifflements) et 2 des nausées. Une HTA a été observée chez un patient qui avait des antécédents d’HTA. Il n’y a pas eu de différence de tolérance entre les groupes 200 mg et 400 mg.
Par ailleurs, afin d’explorer la pertinence d’agir sur la voie de l’IL-13 pour traiter la DA, un travail a évalué la corrélation entre l’expression de l’IL-13 et les biomarqueurs de la DA sur des biopsies de peau et des prélèvements de sérum de patients atteints de DA(10). Les auteurs ont ensuite étudié l’impact d’un inhibiteur de l’IL-13, le tralokinumab, sur des cultures in vitro de kératinocytes et de fibroblas tes stimulés par de l’IL-13.
L’analyse PCR des biopsies de lésions DA a montré une corrélation entre le gène exprimant l’IL-13 et les gènes de la différenciation épidermique, de la synthèse des lipides et de la fonction barrière, ainsi que ceux relatifs aux cytokines impliquées dans l’attraction des cellules immunitaires, le prurit et l’hyperprolifération. La seconde partie de l’étude a montré que le tralokinumab normalisait l’expression de ces biomarqueurs de la DA sur les cultures de kératinocytes stimulés par l’IL-13. Ces résultats incitent à poursuivre le développement des inhibiteurs de l’IL-13 dans le traitement la dermatite atopique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :