Publié le 10 mar 2009Lecture 11 min
Intérêt des biothérapies sur l’annexe unguéale
R. BARAN, Cannes
Les progrès réalisés dans la compréhension de la physiopathologie du psoriasis permettent actuellement de considérer cette affection cutanée comme une maladie inflammatoire, secondaire au recrutement et à l’activation anormale des lymphocytes T dans la peau d’individus génétiquement prédisposés (1).
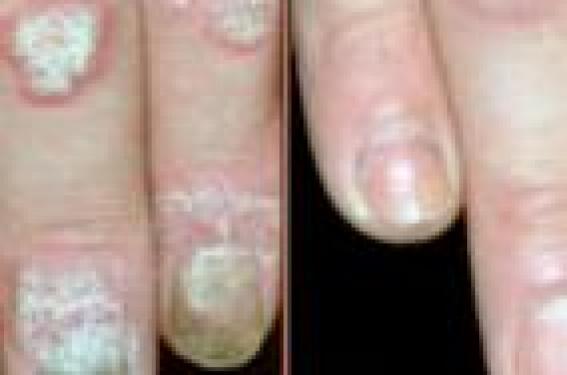
Les avancées des connaissances ont entraîné une révolution dans le traitement systémique du psoriasis avec l’introduction dans notre pratique quotidienne d’une nouvelle classe de médicaments appelés « agents biologiques ». Il s’agit de molécules protéiques obtenues par génie génétique, que l’on classe en anticorps monoclonaux et en protéines de fusion. Trois d’entre elles ont un mécanisme d’action similaire par blocage des effets biologiques du TNFα (Tumor Necrosis Factor alpha) : • L’étanercept (Enbrel®) est une protéine de synthèse qui inactive le TNFα circulant humain. • L’infliximab (Remicade®) est une protéine qui se fixe à la fois sur le TNF circulant et sur le TNF fixé à la surface des cellules, avec pour conséquence une inactivation du TNF dans toutes ses localisations. Comme cette molécule est partiellement humanisée, elle stimule la production d’anticorps anti-infliximab, ce qui diminue parfois rapidement son efficacité. • L’adalimumab (Humira®) est une protéine qui se fixe à la fois sur le TNF circulant et le TNF cellulaire. Molécule complètement humanisée, elle stimule peu la production d’anticorps. L’association de petites doses de méthotrexate aux anti-TNFα semble très utile pour en potentialiser l’efficacité et empêcher la formation d’anticorps anti-infliximab et antiadalimumab. Une seconde famille inhibe la migration et l’activation lymphocytaire dans la peau, les modulateurs des lymphocytes T. Elle comprend l’éfalizumab (Raptiva®), un anticorps monoclonal anti- CD11, et l’aléfacept (Amevive®), protéine de fusion chimérique (non disponible en Europe). Figure 1. A. Psoriasis unguéal avant traitement (Coll. D. Bessis, France). B. Même patient après 22 semaines de traitement par infliximab (soit 4 perfusions). Figure 2. A. Psoriasis unguéal avant traitement (Coll. I. Caro, États-Unis). B. Résultat après 20 semaines de traitement par étanercept. Lésions unguéales du psoriasis : rappels • Les lésions du repli sus-unguéal avec ou sans paronychie (perionyxis) sont fréquentes. • L’atteinte de la matrice engendre des manifestations à type de lignes de Beau, d’onychomadèse (détachement de la tablette à son bord proximal), de trachyonychie (rugosité de la tablette), de leuconychie, mais par-dessus tout, de dépressions cupuliformes (érosions ponctuées), dont les cellules parakératosiques qui les remplissent se détachent rapidement. • Le psoriasis du lit unguéal peut se manifester par des taches d’huile saumonées visibles par transparence. L’onycholyse se traduit par un décollement de l’ongle. Elle est souvent soulignée par un liseré proximal érythémateux. Enfin, l’hyperkératose du lit indique le caractère coalescent des cellules parakératosiques. • Le psoriasis de la région distale du lit et de l’hyponychium produit des hématomes filiformes qui siègent surtout dans la région distale du lit. L’onychoptose s’observe après onychomadèse psoriasique ou après un traitement par acitrétine. Quand traiter les psoriasis avec atteinte unguéale par les biologiques ? Le problème se pose différemment selon qu’il s’agit d’un psoriasis dans sa variété modérée à sévère, avec atteinte unguéale, ou d’une forme unguéale isolée. Lors de l’association cutanéo-unguéale où le traitement local des plaques psoriasiques a échoué et où plus du tiers des téguments est touché, on s’adresse classiquement dans un premier temps aux traitements systémiques de première ligne (5) : acitrétine, méthotrexate, ciclosporine A, PUVAthérapie, UVB et narrow band UVB (211-213 nm) ; et en deuxième ligne (5) : fumarates (6), azathioprine, hydroxyurée, radiothérapie superficielle, rayons de Burcky et electron beam. Chacun de ces traitements de fond comporte des risques de toxicité secondaire à leur utilisation prolongée justifiant les efforts continus de développer de nouvelles molécules. Dans le cas du psoriasis limité à l’appareil unguéal, on traitera différemment selon le siège anatomique de l’atteinte pathologique ; elle peut se manifester sur n’importe quelle structure unguéale, sur plusieurs d’entre elles, voire parfois sur toutes. Du point de vue thérapeutique, il faut savoir qu’en dehors de produits encore non commercialisés (vernis au clobétasol par ex.), les traitements topiques(7) ne sont efficaces que lorsqu’ils sont au contact de la zone pathologique. Mais s’il est aisé de découper chaque semaine une tablette décollée pour traiter le lit avec un corticoïde ou du tazarotène (0,1 %) par ex., il est plus long de supprimer une tablette hyperkératosique par kératolyse à l’urée à 40 % avant de s’attaquer au lit pathologique. En revanche, une seule voie locale permet d’effectuer un traitement relativement efficace de la pathologie matricielle : les injections intramatricielles de corticoïdes à travers le repli sus-unguéal ou bien, après anesthésie locale, des injections latérales, en 4 points, de part et d’autre de l’ongle, pour traiter la matrice et le lit. Lorsque le traitement s’avère insuffisamment efficace, que la qualité de vie du sujet se dégrade, que sa profession exige des doigts à la terminaison parfaite (employée d’une bijouterie, concertiste, dermatologiste, etc.), on a proposé avec un résultat excellent, mais qui n’exclut pas les rechutes, les radiations ionisantes de bas voltage. La dose totale délivrée au cours d’une vie pour une zone donnée ne doit pas dépasser 10 Gy. L’efficacité des traitements systémiques rend leur recours possible compte tenu des indications unguéales mentionnées ci-dessus. Mais à long terme, leurs effets indésirables en limitent la poursuite. C’est dire que l’avènement des biothérapies correspond à un besoin réel de maîtrise de la maladie et de facilité de traitement dans une affection chronique pour laquelle la guérison définitive n’existe pas. Figure 3. A. Psoriasis unguéal avant traitement (Coll. B.E. Strober, États-Unis). B. Résultat après traitement par aléfacept. Que nous apprend la littérature ? À l’instar du PASI pour les lésions cutanées, le NAPSI (Nail Psoriasis Severity Index) est le score utilisé dans les études d’évaluation de l’efficacité des traitements dans les lésions psoriasiques unguéales. Les anti-TNFα Infliximab L. Bianchi et coll. (8) ont traité par infliximab 17 hommes et 8 femmes pour psoriasis en plaques, modéré à sévère et psoriasis arthropathique avec une forme d’onychopathie importante (NAPSI > 14). À la 22e semaine, le NAPSI était à 0, et 12 semaines après la dernière injection, la rémission clinique se poursuivait. W. Hussain et coll. (9) ont administré l’infliximab à deux patients de la quarantaine ayant une dystrophie totale des 20 ongles. Ils ont obtenu une rémission complète après échec de nombreux traitements locaux et systémiques. D. Rigopoulos et coll. (10) ont suivi 18 malades dont 5 atteints de psoriasis arthropathique. Les résultats ont montré une résolution presque complète avec un NAPSI à 3,3 à la 38e semaine contre 55,8 le J 0. P. Rich et coll. (11) ont traité 378 patients randomisés 4:1 avec l’infliximab contre placebo aux semaines 0, 2, 6, et toutes les 8 semaines jusqu’à la semaine 46. Les malades ayant reçu l’infliximab ont eu une amélioration importante et persistante des lésions. Toutefois, cette étude n’a pas été contrôlée au-delà d’une année. Les enzymes hépatiques doivent être surveillées et le développement d’anticorps neutralisants a été observé chez plus d’un quart des patients. Étanercept Une observation anecdotique a été un succès thérapeutique pour E. Rallis et coll. (12). M. de Rie et coll. (13) et G. Aguilar- Garcia et coll.(14) ont également constaté l’amélioration du psoriasis unguéal après 12 semaines d’étanercept. Une onychopachydermo-périostite psoriasique a guéri sous étanercept au niveau des ongles des index et a été fortement améliorée au niveau du gros orteil (15). Le traitement par étanercept ne requiert pas d’examens de laboratoire de surveillance particuliers. Adalimumab M. Dans et coll. (15) ont rapporté un cas similaire à celui de T. Bongartz et coll. (16) pour qui l’amélioration avec l’adalimumab du gros orteil n’était que partielle. Dans une étude multicentrique ayant inclus 442 patients, l’adalimumab a permis d’obtenir une amélioration importante des lésions articulaires, de la peau et des ongles. L’amélioration du NAPSI était indépendante de l’importance des modifications cutanées, et sans rapport avec le statut de la réponse articulaire (17). Les lymphocytes T modulateurs Aléfacept C.T. Cassetty et coll.(18) ont traité par aléfacept 6 psoriasis unguéaux ; 3 d’entre eux ont eu une amélioration de 30 % du score NAPSI. L’amélioration cutanée n’était pas toujours corrélée avec celle des ongles. C.A. Parrish et coll. (19) ont utilisé l’aléfacept chez 15 sujets de 25 à 64 ans, avec un psoriasis modéré à sévère. Cinq malades (33 %) ont obtenu une réduction du NAPSI de 50 % ou plus. J.E.M. Körver et coll. (20) ont traité 8 cas de psoriasis unguéaux. Dans le groupe des patients aux ongles au minimum modérément atteints, 2 malades ont été améliorés, 2 autres n’ont pas remarqué de changement et une aggravation a été constatée chez un patient. N. Korman et coll. (21) ont présenté à l’AAD 2007 le poster d’une étude multicentrique portant sur 449 patients. Tous ont reçu jusqu’à 3 séries d’aléfacept ; chaque série consistait en une injection intramusculaire de 15 mg une fois par semaine pendant 12 semaines, suivie par une période de repos de 12 semaines. Treize à 20 % des patients de l’étude ont montré une amélioration des ongles psoriasiques. Éfalizumab C. Lamerson et coll.(22) rapportent les cas de 4 patients traités par éfalizumab pendant 19 à 33 semaines et concluent que ce traitement contribue à améliorer les lésions unguéales de ces patients. Que savons-nous des effets indésirables des anti-TNFα Effets indésirables des anti-TNF Risque infectieux Contrairement à la population rhumatologique et gastro-entérologique, les immunosuppresseurs sont utilisés pour une période relativement courte dans le traitement du psoriasis. L’extrapolation du risque infectieux observé dans ces populations aux patients psoriasiques n’est probablement pas entièrement fondée( 23). Le TNFα joue un rôle dans la réponse immunitaire anti-infectieuse notamment contre les germes intracellulaires. La principale pathologie infectieuse à redouter est la tuberculose(23). Une réactivation de la tuberculose peut apparaître dans les 2 à 5 mois suivant l’introduction du traitement. Plus de la moitié des formes sont extrapulmonaires. Le risque est cependant différent selon l’anti- TNF utilisé : il est plus important avec l’infliximab et l’adalimumab. Il est par conséquent indispensable avant toute prescription d’anti- TNF de rechercher et d’évaluer le risque tuberculeux par tous les moyens appropriés (IDR, radio des poumons). En cas de tuberculose latente, une prévention thérapeutique doit être mise en route au moins 3 semaines avant la première injection d’anti-TNFα. Une radiographie pulmonaire doit être effectuée tous les 2 mois. Quoi qu’il en soit, en cas de risque infectieux avéré, l’infliximab doit être arrêté durant 6 mois et la surveillance du risque infectieux doit être prolongée jusqu’à l’arrêt complet du médicament. Tous les anti-TNF sont susceptibles d’induire la formation d’auto-anticorps de type lupique. Toutefois, il n’a pas été observé d’influence de ces anticorps sur l’efficacité du traitement ni sur le risque d’hypersensibilité. Risque cancéreux Devant l’apparition d’hémopathies malignes, la prudence est conseillée. Elle exige l’arrêt immédiat de l’anti-TNF. Autres risques Des symptômes neurologiques, en particulier une pathologie démyélinisante de type sclérose en plaques ont été rapportés. L’infliximab et l’étanercept sont contre-indiqués en cas de névrite optique. Une insuffisance cardiaque impose l’arrêt des anti-TNF. Les anti-TNF sont contre-indiqués lors de la grossesse. Effets indésirables des modulateurs des lymphocytes T Ils sont rares et se résument à : thrombocytopénie, anémie hémolytique, aggravation occasionnelle d’un psoriasis (effet paroxystique), arthrite occasionnelle. Quelle biothérapie choisir ? Dans l’état actuel de nos connaissances et compte tenu du risque de survenue d’effets secondaires graves, on retiendra que le niveau de preuve permettant de choisir un agent biologique chez un patient donné est globalement assez faible. En effet, aucune étude comparant les biothérapies entre elles n’est disponible. Toutefois, à la lecture des travaux publiés jusqu’ici, l’infliximab apparaît comme l’agent le plus efficace sur l’appareil unguéal. En revanche, l’éfalizumab pourrait être le traitement de première intention chez des patients atteints de tuberculose, non ou mal traitée, ou de sclérose en plaques. On gardera aussi à l’esprit que la conduite d’un traitement par biothérapie coûte 16 000 à 40 000 $ (soit entre 11 800 et 29 600 € environ) par an.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :