Cheveux, Poils, Ongles
Publié le 31 jan 2016Lecture 14 min
Alopécie androgénétique : diagnostics différentiels et actualité thérapeutique
L’alopécie androgénétique est actuellement considérée comme une alopécie transitionnelle, puisqu’à un stade avancé, la tige pilaire n’est plus produite aboutissant à une alopécie définitive. Un certain nombre de diagnostics différentiels doivent être évoqués devant un tableau clinique d’alopécie androgénétique. Les éléments anamnestiques, trichoscopiques et parfois histologiques permettent, dans la majorité des cas, de rectifier le diagnostic. Nous exposerons ici les principaux diagnostics différentiels à éliminer, les traitements utilisés ainsi que les nouvelles pistes physiopathologiques récentes.
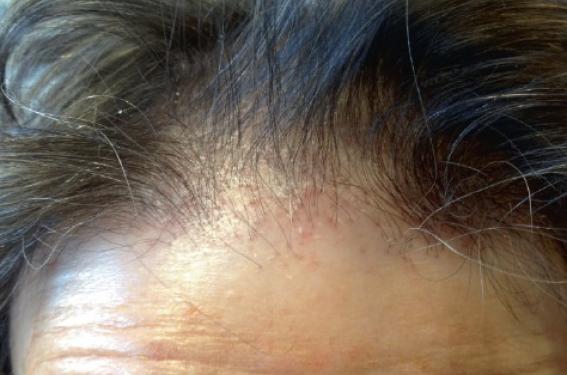
L’alopécie androgénétique (AAG) est une des plus fréquentes causes d’alopécie puisqu’environ 50 % des hommes présentent un certain degré d’AAG à la cinquantaine. Caractéristiques de l’AAG Les rares études génétiques réalisées sont en faveur d’une transmission héréditaire polygénique avec une plus grande fréquence chez les Européens que chez les Africains. De plus grandes études sont nécessaires pour préciser la nature et le nombre de gènes en question. L’AAG est caractérisée par la diminution progressive du calibre des cheveux (miniaturisation), aboutissant plus ou moins rapidement à la perte de la densité capillaire au niveau des golfes et du vertex, épargnant les zones latérales et la région occipitale basse (couronne). Le début de l’affection se fait souvent vers l’âge 20 ans, parfois plus précocement à l’adolescence. L’aspect clinique est le plus souvent caractéristique permettant un diagnostic aisé (figures 1 et 2). Il est parfois plus difficile, surtout au stade de début de l’AAG. Dans cette situation, la dermoscopie du cuir chevelu (trichoscopie) a tout son intérêt pour mettre en évidence le signe pathognomonique de l’AAG : l’anisotrichie ou différence de calibre des tiges pilaires (figure 3). Figure 1. AAG masculine. Figure 2. AAG féminine. Figure 3. Anisotrichie. Diagnostics différentiels Il existe de nombreuses pathologies du cuir chevelu qu’il faut distinguer de l’AAG. • La pelade de type Alopecia areata incognita décrite par Rebora en 1987 touche essentiellement la femme sous la forme d’une pelade à début aigu avec chute de cheveux sévère de type effluvium télogène aigu. Le test de traction est positif avec de nombreux cheveux télogènes ; une trichodynie est souvent associée. Sur le plan trichoscopique, on distingue la présence de points jaunes uniformément répartis sur tout le scalp ainsi que de nombreux cheveux duveteux, parfois dystrophiques. Dans de rares cas, on peut parfois observer des cheveux en point d’exclamation. L’examen histologique confirme l’augmentation du nombre de cheveux duveteux et des cheveux en repousse avec infiltrat lymphocytaire péribulbaire. Selon certains auteurs, l’existence de cette entité est discutée et correspondrait plus à un effluvium télogène aigu sur un terrain d’AAG qu’à une pelade. • L’alopécie frontale fibrosante (AFF), décrite pour la première fois en 1994 chez la femme ménopausée, est caractérisée par la destruction du follicule pileux par une réaction lymphocytaire aboutissant à une alopécie cicatricielle définitive. Le tableau classique consiste en un recul progressif de la ligne frontale antérieure aboutissant à la constitution d’une alopécie cicatricielle en bande de plusieurs centimètres (figure 4) donnant l’aspect en « clown ». L’image trichoscopique est similaire à celle du lichen plan pilaire : hyperkératose périfolliculaire (figure 5), points blancs témoins de la fibrose périfolliculaire et signe du cheveu isolé et halo rosé péripilaire (figure 6), difficile à observer et qui serait plus en faveur de l’AFF que du lichen plan pilaire (LPP). Un début frontotemporal de l’AFF est possible et pose plus de problème de diagnostic différentiel avec l’AAG, l’atteinte des sourcils est un argument en faveur de l’AFF. Figure 4. Alopécie frontale fibrosante (AFF), aspect clinique. Figure 5. Hyperkératose périfolliculaire dans l’AFF et le LPP. Figure 6. Halo érythémateux périfolliculaire, fibrose (points blancs) et signe du cheveu isolé dans l’AFF. • Chez la femme ménopausée une pseudo AAG induite par les inhibiteurs de l’aromatase peut simuler une AAG de type masculin. Les antiaromatases les plus utilisés en France sont le létrozole, l’anastrozole et l’exémestane. Ils induisent une augmentation de l’activité de la 5-alpha réductase qui, par conséquent, augmente la transfor mation de la testostérone en dihydrotestostérone (DHT). La trichoscopie révèle une miniaturisation des cheveux sans anisotrichie et avec une densité capillaire conservée dans les zones fronto-temporales. L’anamnèse retrouvant la notion de prise médicamenteuse est d’un grand secours pour établir le diagnostic. • L’alopécie psychogène, induite par un stress chronique ou aigu, concerne essentiellement la zone centrale du scalp avec respect de la ligne frontale. Une hyperséborrhée ainsi qu’une trichodynie sont souvent associées. La trichoscopie révèle une miniaturisation uniquement de la zone centrale avec micro-inflammation périfolliculaire et follicules vides. La physiopathologie semble incriminer l’action des hormones du stress : neuropeptides, prolactine, facteurs de croissance nerveux, substance P, etc., aboutissant à une apoptose et à une inhibition de la prolifération des kératinocytes pilaires. • L’alopécie temporale triangulaire congénitale, décrite pour la première fois par Sabouraud en 1905, peut prêter à confusion avec une AAG débutante. Le début précoce (vers l’âge de 6 ans), l’aspect grossièrement triangulaire de l’alopécie uni- ou bilatérale au niveau de la zone fronto-temporale (figure 7), l’aspect trichoscopique montrant la présence d’un duvet et l’absence de cheveux terminaux et de points noirs au niveau de la plaque alopécique (figure 8) et l’évolution stable dans le temps sont les éléments distinctifs principaux de cette affection liée probablement à un dysfonctionnement d’un gène impliqué dans la morphogenèse et la différenciation du follicule pileux. Figure 7. Alopécie triangulaire congénitale (ATC), aspect clinique. Figure 8. ATC : duvets et absence de signes trichoscopiques de pelade. Figure 9. Isotrichie dans l’effluvium télogène. • L’effluvium télogène (ET) a été décrit en 1961 par Kligman qui a le premier observé que certains facteurs toxiques, infectieux ou métaboliques pouvaient altérer le cycle pilaire normal et induire une alopécie diffuse et massive à la phase télogène. L’évolution est souvent favorable spontanément malgré le caractère anxiogène de la chute. L’ET aigu apparaît brutalement avec une perte de cheveux quotidienne entre 100 et 1 000 cheveux et une évolution de moins de 3 mois. L’ET chronique est caractérisé par un début plus sournois avec perte de moins de 100 cheveux/j, mais une durée d’évolution prolongée de plus de 6 mois. Les zones temporales du cuir chevelu sont les plus fréquemment concernées. Lors d’ET diffus et massif, il s’y associe le plus souvent une trichodynie. La trichoscopie objective une isotrichie (cheveux de calibre identique) sans inflammation ni points jaunes (figure 9). Sur le plan histologique, on observe une réduction des cheveux terminaux et une augmentation de plus de 20 % du nombre de cheveux télogènes, sans cheveux miniaturisés ou duveteux. Figure 9. Isotrichie dans l’effluvium télogène. • La maladie de Steinert ou dystrophie myotonique de type 1 est une maladie génétique de transmission autosomique dominante. L’anomalie génétique est située au niveau du chromosome 19q13-2. C’est la plus fréquente des dystrophies musculaires de l’adulte avec une prévalence de 1/20 000 habitants. Les patients présentent une alopécie frontale précoce de type androgénétique avec grisonnement prématuré des cheveux, associé à une atteinte multisystémique : musculaire (myotonie, faiblesse musculaire), cardiaque (cardiomyopathie, troubles du rythme cardiaque), pulmonaire (infections pulmonaires récidivantes), ophtalmologique (cataracte bilatérale), endocrinienne (atrophie testiculaire) et retard mental. Certains auteurs ont retrouvé dans la tige pilaire une augmentation des taux d’acide glutamique et une diminution des taux de sérine dans 100 % des cas, et une augmentation de la cystine dans 80 % des cas. • Les syndromes tricho-rhinophalangiens sont des syndromes malformatifs rares, de transmission autosomique dominante liée à des mutations du gène TPRS1 localisé en 8q24.12. Rapportés pour la première fois par Giedon en 1966, ils se traduisent par une petite taille, une alopécie frontopariétale de type AAG parfois aboutissant à une calvitie totale mais sans signes trichoscopiques d’AAG (anisotrichie, orifices folliculaires vides), un nez bulbeux et des épiphyses en cônes, ainsi qu’un raccourcissement sévère de toutes les phalanges, métacarpes et métatarses. Une centaine de cas ont été rapportés dans la littérature. Les symptômes étant plus marqués dans le type 3 avec, notamment, une très petite taille et une brachydactylie très sévère. Le syndrome tricho-rhino-phalangien de type 2 associe, en plus, un déficit intellectuel et des exostoses. Nouvelles pistes physiopathologiques Sur le plan physiopathologique, en plus des classiques facteurs hormonaux et génétiques, de nouvelles pistes physiopathologiques sont évoquées. Il est maintenant admis que les phases classiques du cycle pilaire (anagène, catagène et télogène) dont les durées respectives de 3 ans, 3 semaines et 3 mois, ne sont que des valeurs approximatives et qui en réalité relèveraient plutôt du hasard (comportement stochastique) expliquant la permanence de la chevelure. Si le rôle de la DHT est bien établi dans l’AAG, il semble que cette action ne se limiterait pas qu’au follicule pileux, mais également au niveau des fibroblastes de la papille dermique, qui va se mettre à produire du TGF mais également l’IL-6, qui inhiberait via son récepteur IL-R la prolifération des cellules matricielles et induirait ainsi la régression du follicule. La prostaglandine D2 (PGD2) semble jouer un rôle dans l’AAG. En effet, le follicule pileux est connu pour exprimer l’ensemble des récepteurs aux prostaglandines et être le siège de leur métabolisme. L’accumulation de PGD2 semble inhiber la croissance du follicule. Ce fait est probablement à rapprocher de l’inflammation péripilaire observée dans l’AAG et qui serait à l’origine de la fibrose cicatricielle des AAG évoluées. Certains auteurs préconisent l’utilisation d’un dermocorticoïde en début de traitement par minoxidil ou finastéride, ce qui permettrait d’augmenter leur efficacité et surtout d’éviter l’installation de la fibrose périfolliculaire. Les deux réservoirs de cellules souches du follicule pileux ne sont pas identiques. Le réservoir supérieur contient des cellules CD200+, CD27+, K15+ et K19+, alors que le réservoir inférieur contient des cellules CD34+, CD27+, K19+, ACIX+ , GLUT1+. Ce dernier baigne dans un environnement hypoxique. Le changement de cet environnement hypoxique semble agir sur le taux de cellules souches CD34+, indispensable au bon fonctionnement du follicule. Un article de Toyoshima en 2012 a rapporté pour la première fois la possibilité d’induire la production de poils chez la souris nude en injectant un mélange de kératinocytes de gaine externe avec une culture de fibroblastes de papilles dermiques. Enfin, le lien entre AAG et une éventuelle augmentation du risque cardiovasculaire (maladies coronariennes, syndrome lipodystrophique et HTA) a été évoqué par certains auteurs, mais reste encore discuté à l’heure actuelle. Ainsi, deux voies de recherche intéressantes dans la compréhension de la physiopathologie de l’AAG semblent se dessiner : les cellules souches folliculaires CD34+ et l’environnement hypoxique. Quid des thérapeutiques ? Deux traitements ont été approuvés par la FDA aux ÉtatsUnis avec un niveau d’efficacité fort permettant l’inversion du processus de miniaturisation et la repousse des cheveux dans un certain pourcentage de cas. Il s’agit du minoxidil et du finastéride. • Le mode d’action du minoxidil topique n’est pas complètement connu. En France, le minoxidil 2 % a obtenu l’AMM depuis 1988 dans l’indication AAG modérée de l’homme et de la femme. Le minoxidil 5 % a obtenu l’AMM en 1998 en première intention uniquement dans l’AAG masculine. Le minoxidil augmente la taille des bulbes et des papilles dermiques folliculaires ainsi que le diamètre de la tige pilaire. Ses propriétés vasodilatatrices périfolliculaires puissantes agissant par l’intermédiaire des voies de l’oxyde nitrique et l’ouverture des canaux potassiques, ne semblent pas suffisantes pour expliquer ses effets sur l’inversion de la miniaturisation du cheveu et le prolongement de la durée de la phase anagène aboutissant à une repousse des cheveux avec parfois des résultats spectaculaires. Le minoxidil stimule la croissance des kératinocytes folliculaires in vivo et in vitro en l’absence de toute vascularisation. La forme mousse du minoxidil 5 % est disponible en France depuis 2014. Aux États-Unis, la FDA a étendu son indication à la femme à raison d’une application quotidienne. • Le finastéride a obtenu l’AMM en France depuis 1998 pour les AAG modérées de l’homme seulement. Il s’agit d’un inhibiteur de la 5α-réductase de type 2. À la dose de 1 mg/j, il a montré une efficacité sur le ralentissement ou l’arrêt de la chute de cheveux et sur la repousse dans environ 30 % des cas en comparaison avec un placebo. L’amélioration concerne plus le vertex que la zone frontale et est typiquement observée après 6 mois de traitement. La tolérance du finastéride est bonne sans notion d’interaction médicamenteuse. Dans les études, environ 2 % des patients sous finastéride présentent des effets indésirables d’ordre sexuel (diminution du volume de l’éjaculat, baisse de la libido) régressant rapidement après l’arrêt du traitement. Sur le plan biologique, le taux des PSA peut diminuer. Un dosage des PSA avant de débuter un traitement par finastéride est recommandé. Selon certains auteurs, les très rares cas polémiques de cancer de la prostate rapportés ne permettent pas de conclure à une augmentation du risque de cancer sous finastéride. La combinaison finastéride et minoxidil peut être envisagée dans le but d’obtenir une meilleure efficacité. • Le dutastéride 0,5 mg est un inhibiteur de la 5α-réductase de type 1 et 2 ; il a la même efficacité et les mêmes effets indésirables que le finastéride à 1 mg. Sa demivie d’élimination est cependant beaucoup plus longue que celle du finastéride (800 h pour 6 h). En 2011, un guideline européen du traitement des AAG féminines et masculines a été publié. Il préconise chez l’homme le finastéride per os à 1 mg/j et le minoxidil topique à 2 et à 5 % après 18 ans en cas d’AAG légère à modérée 5 Norwood (II à V) avec un fort niveau de preuve (niveau 1). Une durée minimale de 6 mois pour le minoxidil et de 6 à 12 mois pour le finastéride est nécessaire pour juger de l’efficacité du traitement. Le minoxidil 5 % est plus efficace que le 2 % chez l’homme, mais il n’y a pas assez de données pour recommander la forme mousse par rapport à la lotion. De même qu’il n’y a pas assez d’études comparatives concernant l’utilisation du dutastéride. Chez la femme, seul le minoxidil topique à 2 % est recommandé alors que les antiandrogènes ne le sont pas. Seul l’acétate de cyprotérone peut être envisagé en cas d’hyperandrogénie clinique ou biologique. Le finastéride est contre-indiqué chez la femme en âge de procréer. Il n’y a pas, à l’heure actuelle, de données suffisamment convaincantes pour le recommander chez la femme ménopausée. Traitement chirurgical de l’AAG La technique d’implantation d’unités folliculaires à cheveux longs (FUL), décrite par Pierre Bouhanna, consiste à prélever une bandelette de cuir chevelu (10 à 25 cm de long) et 1 cm de large, découpée, sous microscope, en fragments de 1 à 3 cheveux qui seront implantés dans la zone receveuse. L’intérêt de cette technique est d’avoir un résultat immédiat bien que tout ou partie de ces cheveux tombent dans les 2 ou 3 semaines. La technique d’extraction folliculaire automatisée (SAFER de Médicamat®) ou FUE automatisée, permet le prélèvement d’unités folliculaires directement au niveau de la zone donneuse sans avoir recours à la découpe d’une bandelette. Le système d’aspiration du greffon a permis de réduire considérablement le pourcentage de transsection. Un autre bras sur la machine permet de réaliser l’implantation du greffon dans la zone receveuse. Cette technique est très utile chez les patients qui se rasent les cheveux courts, en cas d’absence de laxité et de souplesse cutanée au niveau de la zone donneuse. Récemment, un nouveau système robotisé (Artas®) permet de prélever les greffons de manière automatique. L’appareil calcule le bon angle d’incidence et permet au chirurgien d’avoir l’image précise de la zone à prélever grâce à une caméra haute définition. Ce robot, dont le coût est très élevé, n’est réservé qu’à de grands centres spécialisés.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :