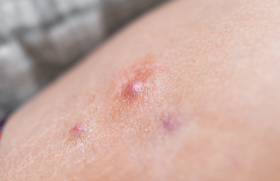
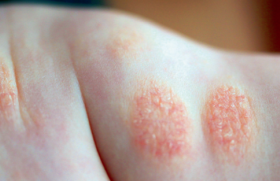
Dermatite atopique, Eczéma
Publié le 13 déc 2022Lecture 16 min
Les dermatoses du gland - Comment prendre en charge une balanite ?
Jean-Noël DAUENDORFFER, Centre de pathologie génitale et IST, service de dermatologie, Hôpital Saint-Louis, Paris
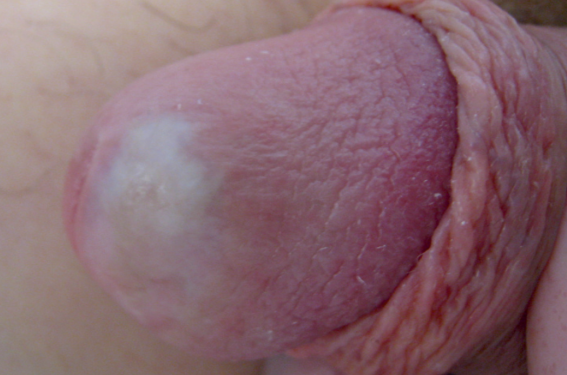
Une balanite correspond à une inflammation du gland, chronique ou aiguë, d’origine infectieuse (Candida albicans, streptocoques, etc.), inflammatoire (lichen scléreux, lichen plan, balanite de Zoon, psoriasis, etc.), allergique ou irritative. Lorsque aucune étiologie ne peut être identifiée doit être évoqué le diagnostic de balanite (ou balanoposthite) non spécifique (BNS), qui correspond à un diagnostic d’exclusion reposant sur un aspect clinique compatible et un bilan étiologique microbiologique voire histologique négatif. Une biopsie est indispensable en cas de doute diagnostique ou de résistance au traitement, car une néoplasie intraépithéliale ou un carcinome épidermoïde peuvent mimer une balanite chronique.
Une balanite correspond à une inflammation du gland, aiguë, chronique ou récidivante(1). L’atteinte du prépuce peut être associée, réalisant une balanoposthite. Les balanites sont plus fréquentes chez l’homme non circoncis. Seront présentées ici, de façon non exhaustive, les causes les plus fréquentes de balanites et celles à ne pas méconnaître du fait de leur gravité, en précisant leurs spécificités cliniques et les modalités thérapeutiques. Les lésions précancéreuses et cancéreuses (néoplasies intraépithéliales, carcinome épidermoïde, maladie de Paget) ne sont pas des balanites au sens strict puisqu’elles ne correspondent pas à une inflammation ou à une infection, mais elles seront abordées succinctement, car leur aspect clinique peut être similaire à celui des balanites inflammatoires ou infectieuses chroniques.
Balanites infectieuses
Balanite candidosique
Les facteurs de risque principaux de balanite candidosique sont : le diabète, l’âge, la prise d’antibiotiques, l’immunosuppression (VIH, médicamenteuse), l’absence de circoncision et l’existence d’un phimosis. À l’examen clinique, on observe le plus souvent une balanoposthite plutôt qu’une balanite ou une posthite isolée. La balanite peut être érythémateuse ou pustuleuse, parfois recouverte d’un enduit blanchâtre détachable à la compresse (figure 1). L’infection sera confirmée par l’examen mycologique, mettant en évidence C. albicans dans la majorité des cas. La recherche d’un diabète et d’une séropositivité VIH doit être systématique en cas de balanite candidosique récidivante ou chronique, du fait de sa rareté de survenue en l’absence de facteur de risque. Il en est de même en cas d’épisode aigu unique sans prise antibiotique préalable. Le traitement fait appel aux imidazolés topiques ou au fluconazole oral. Le choix doit tenir compte du risque d’intolérance locale aux imidazolés topiques (sensation de brûlure) et des nombreuses interactions médicamenteuses du fluconazole oral.
Figure 1. Balanite candidosique pustuleuse.
Autres balanites fongiques
Rarement sont observées des mycoses du gland non candidosiques comme une dermatophytose ou un pityriasis versicolor (Malassezia sp.). Dans ces cas, l’atteinte du gland est habituellement associée à une atteinte du fourreau du pénis, du scrotum et/ou des plis inguinaux.
Balanite streptococcique
L’atteinte à streptocoque du groupe A (SGA) consiste en une balanite ou une balanoposthite érythémateuse, érosive (figure 2) ou pustuleuse, parfois associée à une anite ou périanite chez l’enfant, plus rarement à une urétrite chez l’adulte. Streptococcus agalactiae (streptocoque du groupe B [SGB]) est plus fréquemment isolé dans les balanoposthites de l’adulte que SGA. En cas de balanite à SGA, le traitement repose sur une antibiothérapie adaptée, à débuter une fois le prélèvement bactériologique réalisé.
En l’absence de recommandation spécifique et par analogie au traitement de l’anite streptococcique, l’amoxicilline à la posologie de 50 mg/kg/j en 3 prises (maximum 6 g/j) pendant 21 jours sera prescrite en première intention. Le traitement peut être plus court ou limité à une antibiothérapie locale (acide fusidique ou mupirocine) en cas de balanite à SGB.
Figure 2. Balanite érosive à Streptococcus pyogenes.
Autres balanites bactériennes
Staphylococcus aureus est isolé avec une fréquence variable en cas de balanoposthite. La responsabilité de Gardnerella vaginalis est évoquée par certains auteurs, notamment en cas de vaginose chez la partenaire, mais nuancée par d’autres. Des bactéries anaérobies du genre Bacteroides semblent plus fréquemment isolées en cas de balanoposthite en comparaison avec des sujets sains, notamment en cas de balanite érosive ou ulcérée. Une balanite spécifique peut être associée à l’urétrite à Mycoplasma genitalium, de même qu’une méatite peut traduire une infection à Chlamydia trachomatis ou à gonocoque. La balanite syphilitique de Follmann (figure 3) survient rarement au cours de la syphilis primaire sous la forme d’une balanite érosive. Une atteinte du gland est également possible au cours de la syphilis secondaire, notamment sous la forme de syphilides génitales dénommées Condyloma lata.
Figure 3. Balanite syphilitique de Folmmann.
Balanites parasitaires
Trichomonas vaginalis (TV) est plutôt responsable d’urétrite subaiguë, mais une balanoposthite est possible. Le traitement repose sur le metronidazole per os (2 g en dose unique ou 500 mg, 2 fois par jour pendant 7 jours). Au cours de la gale (Sarcoptes scabiei), le prurit génital est associé à des lésions du gland, du fourreau du pénis et du scrotum, à type de chancres scabieux (lésions papuleuses excoriées) ou de nodules scabieux (figure 4). L’atteinte du gland est, par contre, habituellement absente en cas de phtiriase (morpions).
Figure 4. Nodules scabieux (gale) du gland.
Balanite herpétique
La primo-infection herpétique génitale et les récurrences atteignent le plus souvent le gland et/ou le sillon balano-préputial (figure 5). Les récurrences herpétiques, dans leur forme habituelle, sont précédées de prodromes sensitifs (prurit, sensation de cuisson) sur le pénis et consistent en une plaque érythémateuse se couvrant en quelques heures de vésicules groupées en bouquet et parfois confluentes, qui se rompent pour laisser place à une érosion suintante secondairement croûteuse. Une balanite érythémateuse satellite d’une infection herpétique est possible.
Les récurrences génitales sont plus fréquentes après primo-infection à HSV2 qu’à HSV1. La confirmation microbiologique par PCR HSV 1 et HSV 2 du diagnostic de primo-infection ou de récidive herpétique n’est pas indispensable en cas de certitude clinique. En cas de primo-infection génitale, le traitement repose chez l’immunocompétent sur le valaciclovir 500 mg 2 fois par jour pendant 10 jours. En cas de récurrence génitale, d’autant plus qu’elle est sévère ou prolongée, le traitement repose sur le valaciclovir 500 mg, 2 fois par jour pendant 5 jours. Au-delà de 6 récurrences annuelles, un traitement préventif par valaciclovir 500 mg/j est indiqué.
Figure 5. Primo-infection herpétique.
Autres balanites virales
Un zona génital (VZV) peut être discuté en cas d’atteinte vésiculeuse génitale unilatérale métamérique, à confirmer par une PCR VZV. Les condylomes (papillomavirus) et les molluscum contagiosum (poxvirus) ne réalisent pas au sens strict une balanite mais sont fréquents sur le gland sous la forme de lésions kératosiques volontiers papillomateuses pour les premiers ou ombiliquées pour les seconds. Enfin, des lésions angiomateuses du gland peuvent faire évoquer une maladie de Kaposi (HHV8), à confirmer par un examen histologique et devant faire rechercher une séropositivité VIH (figure 6).
Figure 6. Maladie de Kaposi du gland.
Balanites inflammatoires
Lichen scléreux
Le prurit est le plus souvent absent, contrairement au lichen scléreux (LS) vulvaire(2). Une dyspareunie et des douleurs à l’érection sont possibles en cas de phimosis. Une dysurie à type de déviation du jet urinaire ou de rétention urinaire apparaît en cas d’atteinte méatique ou urétrale et des brûlures mictionnelles surviennent en cas de fissures du prépuce. Le LS affecte le gland et/ou le prépuce, et survient quasiment exclusivement chez l’homme non circoncis. Au stade initial, on observe le plus souvent sur le gland et/ou sur le prépuce des plaques hypochromes porcelainées (figure 7). Des formes inflammatoires sont possibles, posant le problème du diagnostic différentiel avec les autres balanites érythémateuses. En l’absence de traitement, apparaissent un phimosis par sclérose circonférentielle du prépuce, des adhérences balanopréputiales ou une sténose méatique ou urétrale. Le diagnostic de LS génital est le plus souvent clinique. La biopsie n’est pas indispensable lorsque l’aspect réalisé est typique. En revanche, la biopsie des foyers de résistance au traitement (leucoplasie, macule érythémateuse circonscrite, zone bourgeonnante ou verruqueuse, tumeur) est impérative afin d’éliminer une néoplasie intraépithéliale ou un carcinome épidermoïde (CE).
L’apparition d’un CE représente l’une des principales complications évolutives du LS génital. En effet, celui-ci peut faire le lit de lésions précancéreuses (néoplasies intraépithéliales différenciées non-HPV induites ou indifférenciées HPV-induites, hyperplasies épithéliales verruqueuses) pouvant évoluer vers un CE invasif du pénis. Les dermocorticoïdes très puissants (clobétasol propionate crème 0,05 %) sont le traitement de référence du LS génital : une application quotidienne pendant 1 à 3 mois puis un traitement d’entretien pendant plusieurs mois. Une posthectomie totale avec analyse histologique de la pièce opératoire est indiquée en cas de phimosis résistant à la corticothérapie locale et sera suivie, en cas de LS du gland, d’une corticothérapie locale pendant 1 à 3 mois sur le gland ainsi mis à nu.
Figure 7. Lichen scléreux génital.
Lichen plan
Le lichen plan (LP) est une dermatose inflammatoire chronique, pouvant se localiser principalement sur la peau, les muqueuses buccales et génitales, les ongles et le cuir chevelu(3). L’atteinte génitale peut cependant être isolée, sans atteinte cutanée associée. Il est plus fréquent chez l’homme non circoncis. Dans les formes typiques, l’examen clinique montre soit des papules érythémateuses ou violacées, parfois de disposition linéaire, soit une ou plusieurs plaques érythémateuses parfois annulaires, obtenues par confluence de lésions élémentaires multiples ou guérison centrale de plaques. Une atteinte atrophique voire érosive (figure 8) est possible, génitale isolée ou entrant dans le cadre d’un syndrome pénogingival en cas d’atteinte buccale (gingivite) associée. Le LP préputial peut avoir une évolution fibrosante, sous la forme d’un phimosis quoique de façon moins fréquente que le lichen scléreux, ou sous la forme d’adhérences balanopréputiales. La biopsie cutanée ou muqueuse génitale n’est pas indispensable en cas de lésion génitale isolée typique ou d’atteinte extragénitale associée évocatrice. Elle est nécessaire si le diagnostic clinique est incertain, ou en cas de lésion cliniquement suspecte ou ne disparaissant pas sous traitement, afin d’éliminer une néoplasie intraépithéliale pouvant compliquer un LP et évoluer vers un CE pénien. La recherche d’une hépatite C ou d’une dysthyroïdie associée est à discuter au cas par cas. Le traitement de première intention du LP génital repose sur une corticothérapie locale forte ou très forte (propionate de clobétasol 0,05 % crème), et sur le tacrolimus topique en deuxième intention.
Figure 8. Lichen plan érosif génital.
Balanite de Zoon
La balanite de Zoon (ou balanoposthite chronique circonscrite bénigne à plasmocytes) affecte l’homme non circoncis d’âge moyen à avancer. L’examen clinique montre le plus souvent une balanoposthite chronique, sous la forme d’une inflammation du gland et du prépuce en miroir, épargnant classiquement le sillon balano-préputial (figure 9). On observe des placards maculeux brillants bien limités de couleur rouge orangé, ocre ou brune, parfois parsemés de points rouges (aspect dit de « poivre de Cayenne »). La balanite de Zoon est probablement liée à la macération de l’urine entre le gland et le prépuce. La confirmation du diagnostic de balanite de Zoon est indispensable en cas d’aspect clinique non typique ou de résistance au traitement, parfois recommandée de façon systématique. Le traitement le plus efficace est la posthectomie totale, suivie en quelques semaines d’une disparition des lésions du gland. En alternative à la posthectomie ou en cas de refus du patient, une hygiène locale rigoureuse et une corticothérapie locale forte à très forte quotidienne pendant plusieurs semaines peuvent être proposées, quoique rarement efficaces.
Figure 9. Balanite de Zoon.
Balanite non spécifique
La balanite (ou balanoposthite) non spécifique (figure 10) est une balanite de macération survenant uniquement chez l’homme non circoncis. Elle correspond à un intertrigo entre la surface du gland et le feuillet interne du prépuce. Il s’agit d’un diagnostic d’exclu d’exclusion, après élimination des balanites infectieuses et inflammatoires dermatologiques. Une biopsie est indispensable en cas de balanoposthite chronique, en l’absence d’argument clinique ou anamnestique pour une autre étiologie et après élimination d’une infection bactérienne ou fongique. En effet, une lésion balanique érythémateuse chronique (érythroplasie) doit faire éliminer une lésion précancéreuse, voire un CE débutant.
Après l’avoir informé du risque de paraphimosis, on conseillera au patient non circoncis de rester si possible décalotté. Les règles d’hygiène simples doivent être rappelées : toilette quotidienne après décalottage utilisant un produit doux (savon surgras ou syndet), suivie d’un rinçage et d’un séchage soigneux, décalottage au cours de la miction, séchage du gland après la miction, éviction des topiques irritants, utilisation de lubrifiants lors des rapports sexuels, toilette immédiate après un rapport sexuel. Des topiques à base de cuivre et de zinc, des pâtes à l’eau ou une solution diluée de nitrate d’argent peuvent être proposés, mais leur efficacité est limitée et non évaluée. L’utilisation de topiques médicamenteux (ciclopirox olamine crème, dermocorticoïdes de niveau modéré à très fort) peut s’avérer efficace chez certains patients, bien qu’aucune étude ne valide cet usage. En cas d’échec, la posthectomie est le seul traitement constamment efficace.
Figure 10. Balanite non spécifique.
Psoriasis
L’atteinte génitale au cours du psoriasis est fréquente(4). Du fait de l’humidité locale, le psoriasis du gland est souvent érythémateux non squameux chez l’homme non circoncis et érythémato-squameux chez l’hommecirconcis (figure 11).
Le psoriasis génital est associé dans la grande majorité des cas à des lésions extragénitales, l’atteinte génitale isolée ne concernant que 2 à 5 % des patients. Le diagnostic de psoriasis génital est habituellement clinique lorsqu’il existe des atteintes extragénitales typiques (cutanées, unguéales ou articulaires) ou des antécédents familiaux de psoriasis. Cependant, en cas d’atteinte génitale exclusive, la biopsie cutanée ou muqueuse peut s’avérer nécessaire. Les dermocorticoïdes d’activité modérée à forte sont indiqués en première intention pour le traitement de la balanite psoriasique. Le tacrolimus topique, s’il est toléré, peut être utile en traitement d’attaque ou d’entretien (hors AMM). L’efficacité spécifique des traitements systémiques du psoriasis, conventionnels ou biologiques, n’a pas fait l’objet d’études en dehors de l’ixékizumab.
Figure 11. Balanite psoriasique.
Syndrome de Fiessinger-Leroy
Le syndrome de Fiessinger-Leroy (SdFL) ou syndrome oculo-urétroconjonctival correspond à la triade associant urétrite, conjonctivite et polyarthrite aiguë ou subaiguë asymétrique, possiblement associée à des atteintes muqueuses (balanite circinée, érosions buccales), cutanées palmoplantaires, cardiaques ou neurologiques. Il s’agit d’une atteinte réactionnelle à une infection digestive ou génitale (urétrite à Chlamydia trachomatis essentiellement, mais aussi Neisseria gonorrhoeae et Ureaplasma urealyticum) sur un terrain génétique prédisposé (HLAB27+). La triade oculo-urétro-conjonctivale est souvent incomplète. L’atteinte du gland est inconstante, d’autant plus fréquente que le SdFL est secondaire à une infection à Chlamydia trachomatis. Elle se présente sous la forme d’une atteinte psoriasiforme peu spécifique, tantôt érosive humide, tantôt sèche, voire hyperkératosique chez les hommes circoncis. On peut également observer la classique balanite circinée constituée de pustules à évolution squamo-croûteuse groupées en plaques à bords serpigineux (figure 12). Le point de départ, digestif ou vénérien, sera recherché. La balanite circinée répond habituellement aux dermocorticoïdes forts à très forts. En cas d’échec, l’efficacité du tacrolimus (hors AMM) topique voire d’une association tacrolimus topique/dapsone orale ont été rapportées.
Figure 12. Balanite circinée au cours d’un syndrome de Fiessinger-leroy.
Balanite de contact irritative ou allergique
Les dermatites de contact génitales d’origine irritative ou allergique sont peu fréquentes. Les symptômes associent de façon variable un prurit et des sensations de brûlure. Hormis dans le cas d’un eczéma de contact aigu caractérisé par la présence d’un oedème et d’un érythème mal limité, vésiculeux et suintant, ou d’une urticaire de contact au latex se traduisant par un oedème et un prurit d’installation rapide après le rapport sexuel, l’aspect clinique ne permet habituellement pas de différencier une balanite de contact d’origine irritative ou allergique. Le diagnostic de balanite de contact repose donc sur un interrogatoire « policier » des habitudes d’hygiène, complété parfois de tests épicutanés. En cas de dermatite de contact allergique ou irritative, l’éviction de l’allergène, s’il est identifié, est fondamentale. Le recours aux préservatifs en polyuréthane est recommandé en cas d’hyper-sensibilité au latex. Un dermocorticoïde pourra contrôler l’inflammation, voire le tacrolimus topique (inhibiteur de la calcineurine) en cas d’échec des dermocorticoïdes. La prise en charge d’une incontinence urinaire et/ou d’une surinfection sera réalisée le cas échéant.
Érythème pigmenté fixe
Alors que les érythèmes pigmentés fixes (EPF) extramuqueux prédominent chez la femme, la localisation génitale est prépondérante chez l’homme. Les lésions apparaissent 1 jour à 2 semaines après la prise du médicament inducteur, délai qui peut se raccourcir à quelques heures en cas de récidive. L’EPF génital prédomine sur le gland sous la forme d’une plaque érythémateuse, parfois oedémateuse, voire bulleuse. Fréquemment, le patient est vu à un stade d’érosion postbulleuse peu spécifique, rendant indispensable un interrogatoire relatif aux prises médicamenteuses devant toute balanite érosive, d’autant plus qu’elle est récidivante (figure 13). L’évolution est spontanément favorable en quelques jours, laissant de façon inconstante une séquelle pigmentaire. La biopsie n’est pas requise lorsque des lésions compatibles surviennent sur le gland après chaque prise d’un même médicament. Elle est cependant réalisée en cas de doute diagnostique, devant un interrogatoire et un aspect clinique non évocateurs ou en cas de premier épisode. Un bilan allergologique comportant des patch tests in situ est indiqué, notamment lorsque plusieurs médicaments sont imputables. Les anti-inflammatoires non stéroïdiens (piroxicam notamment) sont les médicaments les plus fréquemment responsables d’EPF, suivis des antibiotiques (amoxicilline essentiellement), paracétamol et carbocystéine. La prise en charge de l’EPF génital repose en premier lieu sur l’identification et l’éviction du médicament responsable. Une corticothérapie locale forte à très forte est indiquée à visée symptomatique.
Figure 13. Érythème pigmenté fixe au piroxicam.
Dermatoses bulleuses auto-immunes
Les maladies bulleuses autoimmunes (MBAI) constituent un groupe hétérogène de dermatoses, de sévérité et de pronostic très variables. La pemphigoïde des muqueuses (PM) regroupe les MBAI jonctionnelles avec atteinte muqueuse : pemphigoïde cicatricielle (PC), épidermolyse bulleuse acquise (EBA) et dermatose à IgA linéaire (DIGAL). La PC se caractérise par une atteinte muqueuse prédominante ou exclusive, contrairement aux autres MBAI telles que le pemphigus vulgaire (PV), le pemphigus paranéoplasique (PPN), l’EBA, et la DIGAL. L’atteinte génitale consiste en une balanite ou en une balanoposthite érosive secondairement synéchiante sous la forme d’adhérences balano-préputiales, d’un phimosis ou d’une sténose urétrale (figure 14). Le diagnostic de dermatose bulleuse auto-immune repose sur la corrélation des signes cliniques et des données des examens immunohistopathologiques sur biopsie (examen histologique, immunofluorescence directe voire immunomicroscopie électronique) et sérologiques (anticorps circulants mis en évidence par immunofluorescence indirecte, technique ELISA ou immunotransfert : anticorps anti-BPAG2 pour la PC, anti-desmogléine 3 pour le PV).
Figure 14. Pemphigoïde cicatricielle.
Autres balanites inflammatoires
La localisation d’une dermite séborrhéique sur le gland (balanite séborrhéique) pourrait correspondre à une hypersensibilité à Malassezia furfur ; son diagnostic est évoqué en cas de signes extragénitaux (visage, cuir chevelu, région présternale) de dermite séborrhéique. L’atteinte isolée du gland est rare en cas de dermatite atopique génitale, contrairement à une atteinte plus diffuse pénoscrotale. Les antécédents atopiques personnels ou familiaux (asthme, rhinite allergique, conjonctivite allergique) orienteront vers ce diagnostic. Une maladie du greffon contre l’hôte (GVH) chronique, survenant après allogreffe de moelle osseuse, peut être responsable d’une balanite, proche d’un lichen plan ou d’un lichen scléreux. Une balanite érosive est présente au cours de toxidermies sévères comme le syndrome de Stevens-Johnson et la nécrolyse épidermique toxique (ou syndrome de Lyell) ; l’atteinte du gland n’est alors pas isolée mais associée à une atteinte cutanée et des autres muqueuses. En cas d’érythème polymorphe, qu’il soit post herpétique ou secondaire à une pneumonie à Mycoplasma pneumoniae, la balanite érosive est associée à des érosions buccales et à des lésions cutanées palmo-plantaires en cocarde. En cas de balanite ulcérée, après qu’une infection sexuellement transmissible (herpès génital en premier lieu, chancre syphilitique, primo-infection VIH et selon le contexte un chancre mou, un lymphogranulome vénérien ou une donovanose) a été éliminée, peuvent être évoqués un aphte isolé ou, entrant dans le cadre d’une aphtose, une maladie de Behçet, un syndrome autoinflammatoire (Periodic Fever, Aphtous Stomatitis, Pharyngotonsillitis, Cervical Adenitis [PFAPA], Mouth and Genital ulcers with Inflammed Cartilage [MAGIC syndrome]), une hémopathie maligne (principalement leucémie myélomonocytaire aiguë ou neutropénie), un pyoderma gangrenosum , une ulcération médicamenteuse aphtoïde, une ulcération d’origine traumatique ou caustique.
Lésions précancéreuses et cancéreuses du gland
Les lésions précancéreuses et cancéreuses (néoplasies intra-épithéliales, CE) ne sont pas des balanites au sens strict puisqu’elles ne correspondent pas à une inflammation ou à une infection. Elles sont abordées ici succinctement, car leur aspect clinique peut être similaire à celui des balanites inflammatoires ou infectieuses chroniques. Les néoplasies intraépithéliales (NIE) partagent une définition histologique : ce sont des lésions définies par la présence d’atypies cytologiques et architecturales kératinocytaires intraépithéliales ne franchissant pas la membrane basale(5) . Elles ont aussi en commun une évolution variable, allant d’une possible régression spontanée pour certains types de NIE à des formes micro-invasives puis invasives. Elles constituent de potentiels précurseurs du CE du pénis. Il existe 2 grands types de NIE dont l’étiologie, le potentiel évolutif et le traitement sont différents : les NIE liées au papillomavirus humain (NIEHPV) et les NIE non liées à l’HPV, dites NIE différenciées.
En ce qui concerne les NIE HPVinduites, il est habituel de distinguer sur le plan clinique :
la papulose bowénoïde, multifocale, réalisant typiquement des papules multiples grisâtres ou pigmentées, parfois blanches ou érythémateuses possiblement regroupées en plaques. Cette forme est l’apanage des sujets plus jeunes ;
La maladie de Bowen (ou CE in situ), plus volontiers monofocale, réalisant une plaque d’extension lente et centrifuge, de couleur variable, habituellement rouge (anciennement dénommée érythroplasie de Queyrat sur le gland), et/ou blanche (leucoplasique) (figure 15). Cette forme est plus fréquente chez les sujets au-delà de 50 ans.
Le traitement de la maladie de Bowen est chirurgical ou conservateur (imiquimod [hors AMM], 5-fluorouracile, photothérapie dynamique [hors AMM], vaporisation au laser CO2 ou Nd-YAG). Un traitement conservateur est indiqué en cas de papulose bowénoïde, alors que l’exérèse chirurgicale est proposée en première intention pour une NIE différenciée ou une hyperplasie épithéliale verruqueuse.
Figure 15. Maladie de Bowen (néoplasie intra-épithéliale HpV induite) du gland.
Conclusion
Les causes des balanites sont multiples. En pratique, les plus fréquentes sont la candidose en cas de balanite aiguë au cours ou au décours d’une prise d’antibiotique, et la balanite non spécifique liée à la macération de l’urine entre le gland et le prépuce en cas de balanite récidivante ou chronique chez un homme non circoncis. Une biopsie est cependant indispensable en cas de doute diagnostique ou de résistance au traitement car un carcinome épidermoïde peut mimer une balanite chronique
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :