Publié le 26 aoû 2009Lecture 16 min
Une nouvelle jeunesse pour le méthotrexate dans le psoriasis
H. BARTHÉLÉMY*, R. VIRABEN** *Centre hospitalier, Auxerre **Hôpital La Grave, Toulouse
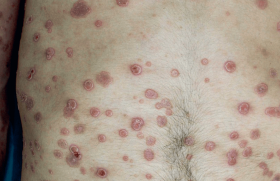
Passage obligatoire entre les traitements locaux et les biothérapies, l’intérêt du méthotrexate dans le traitement du psoriasis a été réévalué. Des perspectives nouvelles sont en évaluation : association avec les biothérapies, traitement topique, détermination sur une base génétique des patients répondeurs.
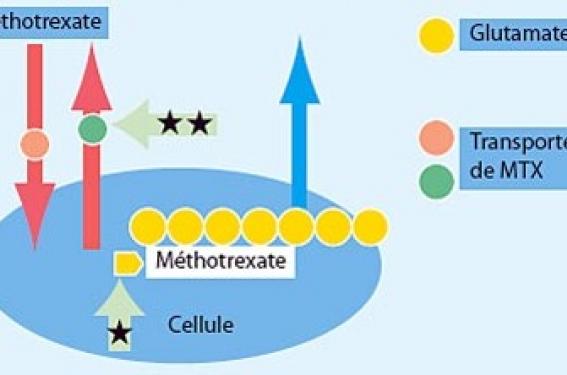
Le méthotrexate (MTX) est un cytostatique antagoniste de l’acide folique, introduit dans la pharmacopée et reconnu dès 1951 comme traitement du psoriasis par Gubner (1). Ce n’est que 20 ans plus tard que la FDA approuva son utilisation dans cette indication et précisa les règles de prescription. Le déclin de son utilisation fut lié à l’apparition de nouveaux traitements : PUVAthérapie puis rétinoïdes et ciclosporine. Il fut précipité à partir de 1988 par les recommandations concernant le risque hépatique et incluant systématiquement la biopsie hépatique dans les protocoles de surveillance. L’apparition des biothérapies a paradoxalement entraîné un regain d’intérêt pour le plus ancien des traitements systémiques du psoriasis. En effet, l’utilisation du méthotrexate est l’un des préalables à la prescription d’une biothérapie. Les nouveaux traitements ont ainsi incité à évaluer le MTX chez des patients qui n’avaient jamais eu recours à cette thérapeutique. Efficacité du traitement Le MTX n’a jamais fait l’objet d’une étude rigoureuse, contrôlée en double aveugle contre placebo. Son utilisation très ancienne explique sans doute cette absence d’évaluation. Chez environ les trois quarts des patients traités, le MTX réduit la sévérité de la maladie d’au moins 50 %. Les résultats doivent être analysés en termes de blanchiment et de maintenance. L’efficacité s’observe parfois dès les premières semaines de traitement et elle est maximale entre le 2e et le 3e mois. Elle concerne, outre les psoriasis en plaques, les psoriasis palmo-plantaires, les formes pustuleuses (à l’exception peut-être de l’acrodermatite de Hallopeau) et érythrodermiques (1). Le rôle du MTX dans le maintien de la rémission à long terme avec des doses maximales de 15 mg par semaine est manifeste à 3 ans chez plus de 75 % des patients. Chez environ les trois quarts des patients traités, le méthotrexate réduit la sévérité de la maladie d’au moins 50 %. Généralement, il n’existe pas de phénomène de rebond lors de l’arrêt du MTX. Seuls les psoriasis aigus et généralisés justifient un arrêt progressif. Une étude contrôlée a comparé l’efficacité de la ciclosporine 3-5 mg/kg/jour et le MTX 15- 22 mg/semaine. L’efficacité est comparable à 12 semaines, soit un PASI 75 chez 60 % des patients contre 68 % pour la ciclosporine, celle-ci agissant toutefois plus rapidement (2). Le MTX est moins efficace que les biothérapies (adalimumab), mais il existe une seule étude comparative dans laquelle la posologie du MTX est discutable (3). Mécanisme d’action Le mécanisme d’action exact n’est pas connu. Il était autrefois admis que le MTX inhibait la prolifération épidermique en bloquant la synthèse de l’ADN. Aux doses proposées l’effet thérapeutique semble plutôt résulter d’un effet anti-inflammatoire. Les plus récents travaux (4) mettent en évidence une diminution de l’activation des lymphocytes T par effet antifolate. De plus, le MTX induirait une diminution de l’expression des molécules d’adhésion : ligand d’intégrine (en particulier ICAM-1) ou sélectine. L’addition de glutamate sur la molécule de MTX et l’accumulation d’adénosine semblent être les étapes clés de cette dernière action indépendante de la voie des folates. D’autres effets ont été mis en évidence : diminution du chimiotactisme des polynucléaires neutrophiles et inhibition de l’activité des cytokines sans relation avec un mécanisme intermédiaire moléculaire précis. Effets secondaires du méthotrexate Les effets secondaires du méthotrexate semblent très dépendants du contexte clinique d’utilisation du médicament. La toxicité hépatique est le problème majeur de la prescription du méthotrexate dans le psoriasis à long terme. La fibrose hépatique complique un traitement par méthotrexate avec une incidence de 0,4 % dans la polyarthrite rhumatoïde et de 4 % dans le psoriasis, et peut être simplement expliquée par la présence d’autres facteurs de risque chez les psoriasiques. Les tests biologiques hépatiques sont peu sensibles pour dépister une hépatotoxicité ; il est donc classiquement recommandé de détecter l’apparition d’une fibrose hépatique par ponction biopsie du foie à réaliser dès qu’une dose cumulée de 1,5 g de méthotrexate est atteinte (pour les patients sans facteur de risque particulier). Elle est répétée tous les 1,5 g de méthotrexate. L’évaluation histologique de la fibrose débutante est relativement reproductible entre plusieurs observateurs. Toutefois, le problème doit être apprécié à sa juste mesure. Il est classiquement recommandé de détecter l’apparition d’une fibrose hépatique par ponction biopsie du foie dès qu’une dose cumulée de 1,5 g de méthotrexate est atteinte. Une étude réalisée en Angleterre entre 1969 et 2004 montre que, sur 105 décès imputés au MTX chez des psoriasiques traités, 67 sont liés à des problèmes hématologiques, 30 pulmonaires et seulement 8 hépatiques. L’incidence de la fibrose hépatique évaluée chez 125 patients psoriasiques suivis par ponction biopsie hépatique (PBF) est de 15 %. Elle se développe à partir de 1,5 g de dose cumulée. Au-delà de 4 g de dose cumulée, pour certains, le risque reste proportionnel à la dose, et pour d’autres, au contraire, il n’existe plus de risque d’apparition d’hépatotoxicité et le traitement peut être poursuivi indéfiniment. Cette recommandation, qui a prévalu jusqu’à maintenant, est de plus en plus remise en cause. De nombreuses études proposent un suivi de la fibrose hépatique par un dosage sanguin de l’aminopeptide terminal du procollagène III (pro c III), mais une atteinte articulaire augmente le taux sanguin de pro c III sans existence obligatoire de fibrose hépatique. De plus, les dosages doivent être réalisés au moins 3 fois par an ; en effet, seule la variation du taux est significative. Peu de centres en France peuvent réaliser ce dosage qui n’est pas pris en charge par l’Assurance maladie. Deux nouvelles investigations non invasives permettent de dépister une fibrose débutante : – le fibrotest est une analyse de 5 paramètres biologiques qui aboutit à un score permettant de détecter une fibrose débutante ; un état inflammatoire biologique peut altérer le résultat ; – le fibroscan est une appréciation de l’élasticité hépatique par ultrasons ; l’examen peut être impossible chez un sujet obèse. L’utilisation combinée de ces deux techniques reste à évaluer mais semble un moyen de surveillance prometteur. Elles sont en effet complémentaires : la première est sensible, la seconde spécifique (5). La toxicité pulmonaire est un effet secondaire redouté plus fréquent dans un contexte de polyarthrite (0,3 % à 18 %) que dans celui de psoriasis (0,03 %). La préexistence d’une pneumopathie infiltrante diffuse liée à la polyarthrite et l’âge moyen élevé des patients expliqueraient cette incidence. Il s’agit d’une pneumopathie d’hypersensibilité apparaissant en général précocement, sans relation avec la dose. Elle se manifeste par fièvre et toux ; le diagnostic, difficile, repose sur le TDM et le lavage broncho-alvéolaire. Aucune recommandation spécifique d’examen complémentaire ne peut être formulée concernant le bilan pré-thérapeutique ou la surveillance du traitement. Seules les données anamnestiques et cliniques orientées vers la sphère respiratoire doivent être collectées dans le cadre de ces bilans. La toxicité hématologique s’observe également essentiellement en cas de traitement de polyarthrite rhumatoïde. Il peut s’agir de pancytopénies de mécanisme immunoallergique. En général directement liée à la dose, elle apparaît comme une conséquence d’un surdosage favorisé par l’âge, l’hypoalbuminémie, l’insuffisance rénale et les interactions médicamenteuses. Une anémie macrocytaire peut aussi être observée, résultant d’une double carence en folates et en vitamine B12 au cours d’un traitement prolongé. En pratique, le risque hématologique est faible sauf en cas d’association médicamenteuse, en particulier avec l’acide salicylique et le sulfaméthoxazole triméthoprime. Les complications aiguës • Des ulcérations cutanées ont été décrites chez les sujets âgés ; elles sont favorisées par l’insuffisance rénale et la prise d’AINS. Elles se voient autant en peau saine que psoriasique. Les douleurs d’une plaque lésionnelle doivent faire craindre leur survenue. • Quelques cas de fractures de fatigue, de gynécomastie et d’oligospermie ont également été rapportés. • Il existe un risque potentiel de tératogénicité chez l’homme persistant 6 mois après la fin du traitement. • Le risque infectieux est faible. • Les rares cas de lymphomes et de cancers solides ont été décrits chez des patients recevant ou ayant reçu d’autres thérapeutiques inductrices. L’efficacité du méthotrexate dans le psoriasis est donc bien établie. Le seul obstacle à sa prescription est le risque de fibrose hépatique nécessitant une surveillance par la PBF. L’abandon de cette pratique devrait permettre une utilisation plus large de ce médicament. Utilisation pratique Indications En France, des mentions légales encadrent l’indication du MTX dans le psoriasis. La prescription peut concerner : – les psoriasis érythrodermiques et pustuleux ; – les psoriasis à grandes plaques étendus au-delà de 20 % de la surface corporelle ; – les psoriasis résistants aux thérapeutiques classiques (PUVAthérapie, rétinoïdes). Aux États-Unis, le retentissement de la dermatose sur l’activité professionnelle est également pris en considération. Les contre-indications suivantes doivent être prises en compte : – insuffisances hépatique et rénale sévères ; – insuffisance respiratoire chronique ; – allergie ; – désir de maternité (arrêt du traitement 3 mois avant la conception) ou de paternité (arrêt du traitement 6 mois avant) ; – vaccination contre la fièvre jaune ; prise de phénytoïne, de probénécide, de triméthoprime, de phénylbutazone, de salicylés. Mode d’administration Plusieurs modalités d’administration sont théoriquement possibles. La prise orale unique est la modalité d’administration la plus courante. Une dose test de 2,5 à 5 mg est recommandée pour détecter les patients qui ont une prédisposition pour les effets toxiques sur la moelle osseuse. La dose initiale proposée est alors de 10 à 15 mg par semaine, que l’on augmente chaque semaine de 2,5 à 5 mg (encadré 1). La dose maximale est de l’ordre de 30 mg par semaine. Une fois le résultat clinique obtenu, la décroissance se fait jusqu’à obtenir la dose minimale efficace. Cette dose est modulée selon les poussées de psoriasis. Certains restent attachés (sans base rationnelle probante) à un fractionnement de cette dose sur 3 prises à 8 h d’intervalle. La dose maximale est de l’ordre de 30 mg par semaine. La voie parentérale peut être justifiée pour des posologies au-delà de 20 mg. En effet, pour des posologies plus faibles, la voie orale est à privilégier car, à ces doses, la biodisponibilité est comparable. L’administration topique avait été proposée dès 1967 avec une efficacité qui semble certaine mais dans des études ouvertes à effectif restreint. Après une longue période de désintérêt pour cette voie d’administration, de nouvelles formes galéniques (liposomes) sont en cours d’évaluation. Supplémentation en acide folique L’acide folique est largement utilisé pour prévenir les effets secondaires du traitement, en particulier effets hématologiques, nausées et ulcérations cutanées. Il n’existe pas de consensus sur l’intérêt d’un tel traitement, la supplémentation étant susceptible de diminuer l’efficacité thérapeutique. Une prescription d’une petite dose (inférieure à la prescription hebdomadaire de MTX) peut être proposée à distance de la prise de MTX (encadré 2). Le folinate de calcium (acide folinique) est réservé à la correction des accidents aigus liés à un surdosage du MTX (6). Pharmacocinétique et pharmacogénétique (7) Pharmacocinétique Le méthotrexate intervient dans la cellule sous une forme active résultant de l’addition de glutamate (jusqu’à 7 résidus). Cette réaction biochimique est dépendante d’une activité enzymatique variable selon les sujets. Une forte concentration en glutamate intra-érythrocytaire pourrait être ainsi prédictive d’un patient bon répondeur au MTX (figure). Cette spéculation n’a pas à ce jour été validée en pratique. Pharmacogénétique Un polymorphisme génétique peut rendre compte d’une altération de l’expression ou de la fonction d’enzyme clé dans le métabolisme du MTX. Il a été ainsi démontré que les enzymes responsables du transport actif du MTX à l’intérieur de la cellule ont une activité variable pouvant induire une baisse d’efficacité du MTX. Une relation peut ainsi être établie entre une mutation limitée à un seul nucléotide sur le gène du transporteur et l’efficacité d’un médicament. Les traitements combinés L’utilisation du MTX en association avec une autre thérapeutique vise deux objectifs : – une augmentation de l’efficacité en additionnant sur le modèle de l’oncologie les bénéfices de deux traitements actifs synergiques ; – une diminution des effets secondaires par une épargne des doses requises pour une efficacité thérapeutique. À côté des traitements simultanés, il a été également proposé une stratégie rotatoire utilisant un traitement systémique pendant une période déterminée et en changeant de traitement à l’issue afin de réduire la toxicité liée à l’accumulation des doses. Dans tous les cas, l’élaboration d’un projet thérapeutique est nécessaire, prenant en compte le caractère chronique de l’affection, son profil évolutif, les éventuelles pathologies associées et la gravité ressentie de l’affection se traduisant par un impact sur la qualité de vie. Les traitements classiques L’utilisation de la corticothérapie locale dans le but de diminuer les doses de MTX n’a jamais été évaluée dans le cadre d’une étude contrôlée. La pénétration et la sortie du MTX dans la cellule sont sous la dépendance de transporteurs génétiquement déterminés. Le MTX cellulaire est activé par l’ajout de résidus de glutamate (jusqu’à 7). Une fois activé, le MTX peut sortir librement de la cellule. Il existe donc au moins deux modulations possibles de l’activité du MTX. Les dérivés de la vitamine D topique ont fait l’objet d’une étude contrôlée multicentrique. La combinaison est bien tolérée et permet une épargne des doses cumulées de MTX. Après l’arrêt du MTX, le traitement topique prolonge significativement la rémission clinique. L’association du MTX et de la ciclosporine est potentiellement dangereuse. La ciclosporine augmente la toxicité du MTX en diminuant son élimination urinaire. Les effets immunosuppresseurs s’additionnent : la ciclosporine inhibe IL-2, l’IFNγet IL-3 tandis que le MTX agit sur l’IL-1. L’impact à long terme sur la carcinogenèse de l’association des deux thérapeutiques n’a pas été évalué. Nous avons observé l’évolution fatale d’un patient porteur de cancers cutanéo-muqueux multiples avec présence de plusieurs types d’HPV oncogènes. Cependant, ce mécanisme peut être aussi responsable d’une meilleure efficacité de la thérapeutique. Une seule étude a été publiée sur le bénéfice thérapeutique d’une telle association dans la polyarthrite rhumatoïde. Les données sont manquantes dans le psoriasis. L’association avec les rétinoïdes. Le bénéfice thérapeutique a été démontré. La base pharmacologique pourrait être l’augmentation du taux sérique du MTX induite par les rétinoïdes. Une augmentation de l’hépatotoxicité pourrait donc résulter d’une telle association. La photothérapie PUVA et UVB est certainement efficace. Le MTX permet de réduire considérablement les UVA administrés. Toutefois, il existe un risque potentiel majoré de promotion de tumeurs cutanées. De plus, le MTX augmente la photosensibilité. Il existe un risque théorique de « recall reaction » dû aux UV que l’on observe après des chimiothérapies antinéoplasiques incluant le MTX ; celui-ci semble plus théorique que réel aux doses utilisées dans le psoriasis. Des réactions phototoxiques prolongées ont toutefois été rapportées dans le cadre d’une telle association. Les biothérapies (8) L’efficacité et la tolérance de l’association du MTX avec une biothérapie n’ont pas fait l’objet d’évaluation dans le psoriasis cutané. Quelques observations isolées sont disponibles. Le bénéfice thérapeutique est surtout extrapolé à partir des résultats obtenus dans d’autres indications en rhumatologie et en gastroentérologie. Toutefois, le risque de lésions irréversibles, mutilantes qui existe en pathologie articulaire justifie l’utilisation de traitements plus agressifs que pour une pathologie cutanée dans laquelle une restitution du tégument est toujours possible. L’infliximab a montré son efficacité en association avec le MTX dans la polyarthrite rhumatoïde résistante au MTX seul au cours d’études contrôlées. Dans quelques psoriasis cutanés ne répondant plus au traitement malgré des perfusions rapprochées, le MTX permet à faible dose (7,5 mg/semaine) d’obtenir un bénéfice thérapeutique. L’appréciation des effets secondaires de cette association est à son début : celle-ci doit donc être considérée comme de dernier recours pendant une courte durée. L’étanercept a été également utilisé avec succès en association avec le MTX dans la polyarthrite rhumatoïde et dans le psoriasis sur une petite série. L’éfalizumab a été utilisé dans la pratique en association avec le MTX, surtout de façon transitoire en début de traitement pour éviter une poussée inflammatoire ou à l’arrêt pour éviter un phénomène de rebond. L’adalimumab a fait l’objet d’une étude d’efficacité en association au MTX dans la seule polyarthrite pour l’instant. Le méthotrexate apparaît donc à l’heure des biothérapies une thérapeutique sûre efficace et de faible coût. L’association MTX-biothérapies mérite d’être entièrement évaluée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :