Publié le 26 juil 2010Lecture 14 min
Prise en charge thérapeutique du rhumatisme psoriasique
D. WENDLING, CHU et EA 3186 « Agents Pathogènes et Inflammation » Université de Franche-Comté, Besançon
L’arrivée des biothérapies a généré un nouvel intérêt pour le rhumatisme psoriasique, avec la nécessité d’une meilleure définition de la maladie, la recherche de nouveaux critères de classification ou de diagnostic de la maladie, la validation de critères d’évaluation de la maladie, et l’individualisation de facteurs pronostiques permettant une stratégie thérapeutique rationnelle.
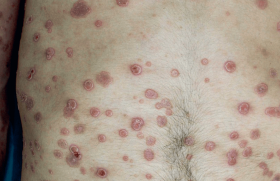
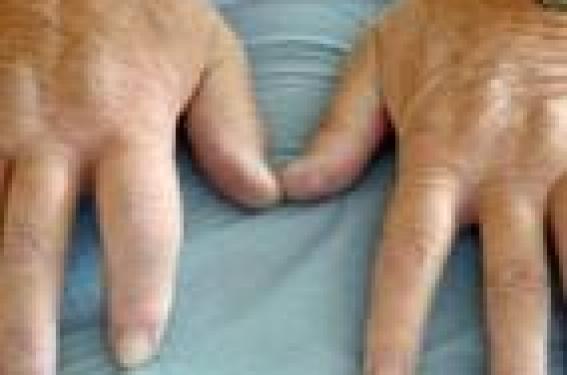
Le rhumatisme psoriasique (RP) occupe une place à part au sein des rhumatismes inflammatoires chroniques, à mi-chemin entre la polyarthrite rhumatoïde d’une part et la spondylarthrite d’autre part. Ce rhumatisme inflammatoire se caractérise par un polymorphisme d’expression clinique tout à fait original et une évolution variable. Les connaissances physiopathologiques ont été à l’origine du rapprochement nosologique au cadre des spondylarthropathies. Le rhumatisme psoriasique Le rhumatisme psoriasique est une maladie polymorphe, avec absence fréquente de parallélisme entre la sévérité de la dermatose et la survenue et la sévérité des manifestations rhumatologiques. Depuis la classification de Moll et Wright (1973), cinq formes principales de rhumatisme psoriasique sont individualisées : – la forme polyarticulaire ; – la forme oligo-polyarticulaire ; – l’atteinte prédominante de l’interphalangienne distale ; – la forme axiale prédominante (isolée 5 %, associée à une autre forme 40 %) ; – et l’arthrite mutilante. D’autres manifestations rhumatologiques peuvent s’associer à chacune de ces formes cliniques (figures 1 et 2) : c’est le cas de la dactylite, de l’atteinte enthésiopathique ou de la paroi thoracique antérieure, qui sont évocatrices du diagnostic, d’une part, et représentent des arguments de regroupement nosologique du rhumatisme psoriasique au sein des spondylarthropathies, d’autre part. Des aspects radiographiques particuliers contribuent à l’individualisation du rhumatisme psoriasique. Figure 1. Dactylites du rhumatisme psoriasique. C’est le cas, en particulier, de la distribution asymétrique des lésions de polyarthrite périphérique, de l’association sur le même site articulaire de signes de destruction (figure 3) et de signes de construction, en particulier sur l’interphalangienne distale. L’ossi fication des enthèses est volontiers plus exubérante que dans la spondylarthrite primitive. L’atteinte axiale peut intéresser les sacro-iliaques, avec les modifications classiques, mais également le rachis, avec parfois un aspect évocateur de syndesmophyte épais suspendu. Ces modifications radiologiques sont évocatrices et peuvent avoir un impact diagnostique, mais leur apparition est tardive, donc peu utile pour un diagnostic précoce. Le psoriasis cutané est banal, présent dans 1 à 3 % de la population générale. Le rhumatisme psoriasique survient dans 5 à 8 % des cas de psoriasis cutané, et représenterait 10 à 15 % des arthrites récentes. En France, la prévalence du rhumatisme psoriasique dans la population générale a été évaluée à 0,14 % en 2001 dans le cadre de l’étude EPIRHUM. Le rhumatisme psoriasique survient dans 5 à 8 % des cas de psoriasis cutané. Le pronostic est variable Souvent crédité d’un pronostic plutôt bénin, en particulier dans les formes oligo- ou mono-articulaires, le rhumatisme psoriasique peut être assorti d’un pronostic défavorable, sur le plan fonctionnel, en particulier pour les formes mutilantes sévères ; il faut également prendre en compte le rôle de la dermatose dans le retentissement global fonctionnel et psychologique. Figure 2. Atteinte des orteils et des ongles. L’ensemble aboutit à une réduction de la qualité de vie par rapport à la population générale, avec augmentation des douleurs et une limitation d’activité due à des problèmes émotionnels. Comme pour d’autres rhumatismes inflammatoires chroniques, le rhumatisme psoriasique est associé à une augmentation de mortalité, avec un ratio standardisé de mortalité à 1,6. Les causes de mortalité dans cette population sont principalement cardiovasculaires. Certains facteurs de pronostic ont été individualisés dans quelques études, tels que l’importance du syndrome inflammatoire biologique initial, la précocité des dégâts radiologiques, l’absence d’atteinte unguéale. Diagnostic du rhumatisme psoriasique De nombreux systèmes de critères de classification ont été proposés pour le rhumatisme psoriasique. Leur multiplicité illustre la difficulté du problème et l’imperfection ou les limites des propositions antérieures. Les derniers rapportés sont les critères CASPAR (2006)(2), élaborés par un groupe d’experts internationaux (tableau 1). Il s’agit cependant de critères de classification, validés en tant que tels ; leur utilité comme critères de diagnostic précoce doit encore être démontrée. Évaluation de la maladie Elle a vu apparaître un certain nombre d’indices, souvent extrapolés à partir d’outils validés dans la PR et dans la spondylarthrite, en fonction de la présentation clinique. Certains indices sont spécifiques ou adaptés au rhumatisme psoriasique. Ainsi, des indices spécifiques peuvent être utilisés pour l’évaluation cutanée et unguéale : le PASI (Psoriasis Area Severity Index) et le NAPSI (Nail Assessment in PsoriaSIs). Sur le plan rhumatologique, l’atteinte articulaire peut être évaluée par le compte articulaire (douleur, gonflement) en prenant en compte l’interphalangienne distale et les pieds, soit un total possible de 66 articulations. Figure 3. Radiographie de l’avant-pied : atteintes articulaires destructrices. L’atteinte axiale peut être évaluée à l’aide des outils classiques de la spondylarthrite : BASDAI, BASFI. Le nombre de dactylites peut être consigné, et pour les enthèses peut être utilisé un des scores proposés (MASES, Mander). La fonction peut être approchée par le HAQ, et la qualité de vie peut l’être par un instrument spécifique, le PsAQoL. Enfin, sur le plan structural radiologique, les scores habituels de la PR (Sharp modifié, Larsen) sont utilisables pour l’étude de la destruction articulaire ; par contre, la composante d’ostéoformation n’est pas appréciée par ces indices, ce qui représente un manque actuellement. L’évaluation de la réponse thérapeutique est un enjeu important, en particulier depuis l’utilisation de thérapeutiques coûteuses et efficaces. Pour l’atteinte périphérique, il peut être fait appel aux outils déjà validés dans la PR : réponse ACR 20 %, 50 %, 70 %, réponse EULAR basée sur l’évolution du DAS (Disease Activity Score). Un instrument spécifique a été mis au point pour l’évaluation des formes périphériques : le PsARC (Psoriatic Arthritis Response Criteria) (tableau 2). Il a été montré que ces trois systèmes d’évaluation de réponse thérapeutique avaient des performances globalement équivalentes. L’évaluation de la réponse thérapeutique est un enjeu important. Suivi du rhumatisme psoriasique – recommandations Des recommandations françaises ont été élaborées dans le cadre des Rencontres d’experts en rhumatologie (RER) 2007 pour la prise en charge du rhumatisme psoriasique (diagnostic, évaluation, suivi et traitement conventionnel). Elles comportent sept points (3) : 1. Pour évaluer l’activité du rhumatisme psoriasique, il est nécessaire de recueillir les éléments suivants : le nombre d’articulations douloureuses et gonflées (y compris les IPD) ; l’existence d’enthésites et de dactylites ; les marqueurs biologiques de l’inflammation ; l’appréciation globale de l’activité de la maladie par le patient (EVA). Il est souhaitable de prendre également en compte le nombre de réveils nocturnes, la durée du dérouillage matinal et la consommation de traitements symptomatiques (grade D). 2. Pour évaluer l’activité du rhumatisme psoriasique à forme polyarticulaire, il est souhaitable de calculer le DAS-28 (grade D). 3. Pour évaluer l’activité du rhumatisme psoriasique, il est nécessaire de prendre en compte l’atteinte cutanée, en collaboration avec le dermatologue, dans les formes modérées à sévères (grade D). 4. Il est nécessaire que ce suivi soit réalisé par un médecin spécialiste en rhumatologie au minimum une fois par an et de façon plus fréquente au début de la maladie ou en cas de forme active ou de changement de traitement (grade D). 5. Pour le suivi du rhumatisme psoriasique, il est important de réaliser des radiographies des articulations symptomatiques. Pour le suivi des formes polyarticulaires, il est important de réaliser des radiographies des mains-poignets de face et des pieds de face. Il est conseillé de réaliser ces explorations tous les ans pendant 2 à 3 ans, puis selon l’évolutivité de la maladie (grade D). 6. Pour évaluer la réponse au traitement dans le rhumatisme psoriasique, il est nécessaire de tenir compte des paramètres d’activité articulaire de la maladie, de l’atteinte cutanée et de la progression radiographique (grade B). 7. Dans la prise en charge du rhumatisme psoriasique, il est important de prendre en compte comme facteur de mauvais pronostic (grade C) : – une atteinte polyarticulaire ; – un syndrome inflammatoire biologique ; – la présence d’érosions radiographiques précoces. Un patient avec rhumatisme psoriasique doit être suivi par un rhumatologue au moins une fois par an. Stratégie thérapeutique L’approche thérapeutique du rhumatisme psoriasique est par essence pluridisciplinaire et doit prendre en compte les aspects rhumatologiques, mais également dermatologiques et de qualité de vie. Il peut être envisagé, d’une part, les traitements conventionnels et, d’autre part, les biothérapies, qui d’emblée permettent de dégager des perspectives thérapeutiques innovantes. Les objectifs thérapeutiques sont de soulager les symptômes douloureux et l’inflammation, de maintenir les capacités fonctionnelles, de prévenir la progression de la maladie, en particulier des lésions ostéo-articulaires, et de maintenir l’espérance de vie. Les traitements conventionnels • Les AINS (anti-inflammatoires non stéroïdiens) sont largement utilisés dans le traitement du rhumatisme psoriasique et sont efficaces dans une majorité de cas. Il n’y a pas de spécificité de classe pour le RP, et les effets secondaires sont identiques à ceux observés dans la PR, même si les AINS ont parfois mauvaise presse auprès des dermatologues vis-à-vis du psoriasis cutané. Rappelons que le psoriasis pustuleux représente une contre-indication classique à l’utilisation des salicylés. • La corticothérapie générale est parfois déconseillée par les dermatologues en raison de la possibilité d’aggravation du psoriasis à l’arrêt de la corticothérapie. Cependant, dans les formes de RP mal contrôlées par les autres traitements, une corticothérapie à faible dose (inférieure à 10 mg/j d’équivalent prednisone) peut être proposée. Lors d’études ouvertes, les bolus de méthylprednisolone se sont révélés efficaces sur les manifestations articulaires et bien tolérés sur le plan dermatologique. • Parmi les traitements d’action lente, la salazopyrine (SZP) a fait l’objet d’études contrôlées positives sur les manifestations articulaires périphériques, avec parfois un effet favorable sur la dermatose aux posologies de 3 g/j. Cette molécule n’a pas l’AMM dans cette indication. Le méthotrexate (MTX) est efficace sur la dermatose et les manifestations articulaires périphériques pour les posologies d’au moins 15 mg/semaine, avec un effet articulaire moins net pour des doses plus faibles. La ciclosporine a montré son efficacité sur la dermatose ; dans une étude contrôlée contre méthotrexate chez 35 RP, l’efficacité articulaire est identique au MTX, mais la toxicité de la ciclosporine est supérieure. Le léflunomide (LEF) a montré son efficacité dans le RP dans le cadre d’une étude contrôlée contre placebo sur 190 RP actifs. À 24 semaines, les pourcentages de répondeurs PsARC sont 58,9 % contre 29,7 % ; il s’y associe également une amélioration cutanée en termes de PASI. Les traitements locaux (infiltrations) et la chirurgie sont possibles et ont des indications voisines de celles de la PR. • Enfin, la prise en charge globale (éducation, information, approche multidisciplinaire, prise en charge psychologique…) est de mise, comme pour tout rhumatisme inflammatoire chronique. Des recommandations pratiques pour le traitement du rhumatisme psoriasique ont été proposées lors des RER 2007(6) (tableau 3). L’évaluation du traitement doit tenir compte de l’activité articulaire, de l’atteinte cutanée et de la progression radiographique. Les biothérapies Les progrès immunopathologiques légitiment leur utilisation dans le RP. Le TNF alpha joue un rôle central dans la physiopathogénie du psoriasis et du RP. Les différents anti-TNF actuellement disponibles (anticorps monoclonaux anti-TNF : infliximab, adalimumab, récepteur soluble p75 du TNF : étanercept) ont montré leur efficacité dans le rhumatisme psoriasique dans le cadre d’études contrôlées. Ainsi, ils sont indiqués en cas de rhumatisme psoriasique actif non contrôlé par le traitement conventionnel. L’efficacité est manifeste dans tous les domaines de la maladie : scores articulaires, scores cutanés, dactylites, enthésopathies, atteinte axiale, qualité de vie, ralentissement de la progression des dégâts radiologiques périphériques(7). Leur utilisation est actuellement entrée dans la pratique courante, et répond aux mêmes précautions et recommandations que les autres indications des anti-TNF. En l’absence de réponse, ou d’échappement, une rotation (switch) d’anti-TNF est possible, comme dans la PR. L’impact médico-économique semble favorable dans cette indication. Des recommandations nationales (CRI/Société française de rhumatologie) sont disponibles pour l’utilisation des anti-TNF dans le RP(8) (tableau 4). Perspectives thérapeutiques Elles sont issues des progrès dans la connaissance physiopathologique du psoriasis et du RP. Certaines options sont déjà utilisées en dermatologie, et sont en cours d’évaluation dans le RP. Ainsi, on peut envisager un impact thérapeutique par : – inhibition de cytokines proinflammatoires ; – inhibition de l’activation cellulaire T ; – déplétion des cellules T pathogènes ; – inhibition du recrutement leucocytaire ; – déviation immune visant à restaurer un équilibre Th1/Th2. ● L’aléfacept (Amevive®) est une protéine de fusion du domaine extracellulaire de la molécule d’adhésion LFA-3 avec la portion Fc de IgG1. Cette biothérapie est utilisée et indiquée dans le traitement du psoriasis cutané chronique en plaques. Cet agent inhibe l’activation des cellules T en bloquant la co-stimulation CD2-LFA-3, facilitant l’apoptose des cellules T mémoires. Une étude contrôlée randomisée contre placebo, dans des cas de rhumatisme psoriasique actif malgré le méthotrexate, chez 185 patients, met en évidence, à la semaine 24, un pourcentage de répondeurs ACR 20 de 54 % dans le groupe aléfacept et 23 % dans le groupe placebo (p < 0,001), avec également une amélioration cutanée. Le profil de tolérance est correct. ● Le CTLA4Ig (abatacept) bloque la co-stimulation des cellules T et peut de ce fait interférer avec la physiopathogénie du psoriasis et du rhumatisme psoriasique. Une étude de phase I en escalade de dose dans le psoriasis a mis en évidence que 46 % de l’ensemble des patients avaient une amélioration d’au moins 50 % de l’activité clinique de la dermatose. Cet agent ayant, entre-temps, obtenu l’AMM dans la polyarthrite rhumatoïde, son utilisation dans le rhumatisme psoriasique paraît donc légitime et est en cours d’évaluation. ● Ciblage de l’IL-23. Cette cytokine pro-inflammatoire, effectrice de la polarisation des cellules T naïves en Th17 est impliquée dans le psoriasis. De plus, il a été récemment montré la relation entre psoriasis, rhumatisme psoriasique et certains variants nucléotidiques du récepteur de l’IL-23. Le ciblage thérapeutique de cette cytokine apparaît donc cohérent. Un anticorps monoclonal recombinant humain, dirigé contre la sousunité p40 commune à IL-12 et IL-23 (ustékinumab) a montré une efficacité supérieure au placebo dans le psoriasis. Ce même anticorps a été évalué dans le rhumatisme psoriasique dans le cadre d’une étude randomisée contre placebo en double insu(9). À 12 semaines, le groupe anti-IL-23 démontre un taux de répondeurs ACR 20, 50, 70 plus élevé (42 %, 25 %, 11 %) que dans le groupe placebo (14 %, 7 %, 0 %, respectivement). Le résultat s’accompagne d’une rémanence de l’effet articulaire à la semaine 36 pour les trois quarts des patients, et d’une amélioration du psoriasis cutané. Figure 4. Stratégies thérapeutiques dans le rhumatisme psoriasique. Le traitement semble bien toléré. Effets thérapeutiques paradoxaux des biothérapies Il faut signaler la possibilité d’effets paradoxaux tout à fait particuliers de certaines biothérapies dans le cadre du psoriasis et du rhumatisme psoriasique : – il a en effet été rapporté la possibilité d’induction ou de réactivation de psoriasis cutané sous traitement anti-TNF, avec un certain nombre d’observations concordantes et une relation temporelle. Il s’agit d’un effet de classe des anti-TNF, avec une prédilection pour les localisations palmoplantaires de type pustuleux(10) ; – citons pour mémoire la possibilité d’apparition de rhumatisme psoriasique chez des patients traités avec succès par éfalizumab pour un psoriasis cutané. L’AMM française et européenne de cet anticorps anti-CD11a a été suspendue en raison de la survenue de cas de leucoencéphalopathie multifocale progressive. Conclusion Le rhumatisme psoriasique est une maladie hétérogène. Sa prise en charge est globale, elle nécessite une évaluation préalable. Le traitement est adapté à la présentation clinique de la maladie (figure 4) et fait appel aux traitements symptomatiques, d’une part, et aux traitements d’action lente, d’autre part. Les biothérapies représentent un apport thérapeutique démontré et soulignent l’importance de la collaboration interdisciplinaire dermatologue/ rhumatologue.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :