Publié le 15 avr 2009Lecture 11 min
Les génodermatoses avec trouble de la kératinisation
D. HOHL*, F. FELLMANN**, *Service de dermatologie et vénéréologie, hôpital de Beaumont CHUV, Lausanne, Suisse **Service de génétique médicale, CHUV, Lausanne, Suisse
Les problèmes génétiques en dermatologie sont plus fréquemment diagnostiqués que dans d'autres systèmes d'organes, sans doute en raison de leur visibilité à la surface de la peau. La pratique clinique de la dermatologie pédiatrique nécessite de bonnes notions sur les génodermatoses et les principes génétiques. Pour cette raison, nous avons établi depuis 5 ans au CHUV une consultation de dermatologie génétique où collaborent dermatologues et généticiens.
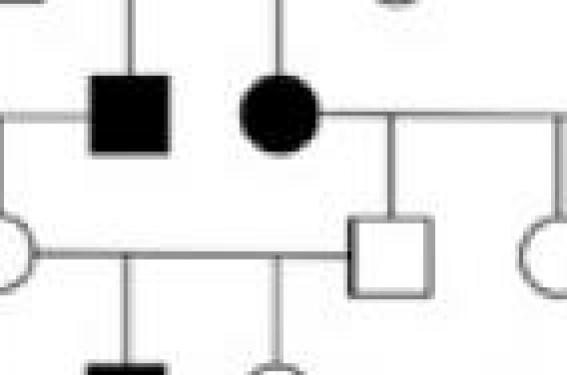
Les génodermatoses sont visibles contrairement aux lésions sectorielles concernant d’autres organes qui passent souvent inaperçues à défaut de retentissement fonctionnel. Avec les progrès récents de la génétique moléculaire, l’anamnèse familiale et la connaissance des bases génétiques sont devenues encore plus importantes pour une prise en charge adéquate de ces patients. De plus, la loi suisse sur l’analyse génétique humaine (LAGH) impose, dès qu’une analyse de génétique moléculaire ou chromosomique est nécessaire pour confirmer un diagnostic clinique, de revoir le patient pour l’informer du résultat de l’analyse et de ses conséquences. Les principes de base de la consultation génétique La consultation génétique a principalement pour but d’aider les patients à comprendre les données médicales de leur maladie, l’hérédité, les risques de récurrence et les options disponibles. Il faut essayer de transmettre un message au patient, qui doit pouvoir se souvenir de l’examen génétique et du diagnostic. L’interrogatoire des patients montre que 30 % ne se souviennent pas 10 ans plus tard qu’ils ont eu un diagnostic génétique, et que 90 % ne se souviennent pas du risque de transmission. Un plan de travail structuré peut combler cette lacune. À partir de la sélection initiale des patients, en collaboration avec les collègues pédiatres et généralistes, il est important de prévoir plusieurs consultations permettant la recherche approfondie d’information, de poser le diagnostic, d’estimer le risque de récurrence, d’organiser la prise en charge du patient et son suivi à long terme. Il est souvent utile aussi de remettre une copie des rapports médicaux aux patients ou à leurs parents. 90 % des patients ne se souviennent pas du risque de transmission. Figure 1. Transmission autosomique récessive. Figure 2. Bébé collodion (a), ichtyose lamellaire type 1 (b) et ichtyose lamellaire en maillot de bain (c). Au cours de la première consultation, nous établissons un arbre généalogique avec les noms et les origines des apparentés. Dans ce contexte, il est utile de rappeler que « mater semper certa est », mais cela est un petit peu moins vrai pour le père : 10 à 20 % des pères de famille ne le sont pas génétiquement. Pour l’examen clinique qui suit, il est conseillé d’établir une documentation photographique. Elle est particulièrement utile en cas de particularités cliniques ou de difficultés diagnostiques. La documentation sert d’aide-mémoire visuel, permet la comparaison avec des ouvrages de référence, des publications et archives, elle est utile pour les études longitudinales ou permet encore de demander conseil aux collègues spécialistes. Au cours des consultations, les différents aspects concernant le diagnostic évoqué, les traitements, le pronostic, le risque éventuel d’invalidité, le risque de transmission aux enfants sont présentés. Un consentement éclairé est demandé lorsque des analyses génétiques sont prescrites et un nouveau rendez- vous est fixé lorsque les résultats sont disponibles. Les modes de transmission Transmission autosomique récessive Figure 3. Transmission récessive liée au sexe. Les allèles hérités de chaque parent sont touchés (figure 1). Les deux mutations peuvent être identiques (on dira alors que le patient est homozygote) ou différentes (on parle alors d’hétérozygote composite). Les parents sont des porteurs obligatoires et chaque enfant a un risque de 25 % d’être atteint par la maladie. Des exemples de ce mode de transmission sont représentés par les troubles de la kératinisation pour lesquels notre clinique est un centre d’excellence. Les bébés collodions sont rares, mais constituent une urgence néonatale. Même avec le soutien de la néonatologie intensive, environ 10 % décèdent pendant la phase périnatale. La majorité des cas vont développer une ichtyose lamellaire de type 1 par déficit de la transglutaminase 1 (figure 2), l’enzyme responsable de la synthèse de l’enveloppe cornée, mais il existe une grande hétérogénéité génétique et, à ce jour, au moins 6 gènes différents ont été identifiés comme pouvant conduire à cette pathologie. Le plus souvent, l’ichtyose lamellaire de type 1 est sévère et généralisée, avec une activité enzymatique effondrée. Plus rarement, on observe une forme mitigée avec une activité enzymatique résiduelle et un aspect d’ichtyose lamellaire « en maillot de bain » (sans atteinte des membres, figure 2). Cela dit, il existe non seulement une hétérogénéité pathogénique mais aussi une variabilité du phénotype au plan clinique qui rend la dermatologie génétique complexe. Elle se réalise volontiers sur la base d’une atteinte variable de la fonction de la protéine mutée. Un autre exemple encore plus grave est le déficit en ABCA12, une protéine transmembranaire importante pour le transport des lipides dans l’épiderme. Cette enzyme peut être défectueuse à un degré variable. Si sa fonction est nulle, le phénotype est celui d’un bébé arlequin. Des mutations plus légères causent une Transmission récessive liée au sexe Figure 4. Ichtyose récessive liée au sexe. Figure 5. Transmission autosomique dominante. La maladie se manifeste principalement chez les hommes. L’allèle muté est transmis par les femmes (figure 3). L’ichtyose récessive liée à l’X touche environ 1 homme sur 5 000. Les femmes hétérozygotes n’ont pas de manifestation cutanée, mais souffrent d’un accouchement prolongé. La maladie est liée à un déficit en stéroïde sulfatase qui entraîne une accumulation du sulfate de cholestérol dans l’épiderme. Chez la femme conductrice, le sulfate d’estriol prolonge l’accouchement. Au plan clinique, la maladie est moins sévère que les exemples qui précèdent (figure 4). Les mutations identifiées correspondent souvent à des délétions complètes du gène STS (codant pour la stéroïde sulfatase) qui peuvent aussi emporter des gènes voisins. Ces situations constituent alors un syndrome de gènes contigus, l’ichtyose étant associée à un retard mental (syndrome de Rud), un hypogonadisme avec anosmie (syndrome de Kallmann), ou encore à un albinisme oculaire. Transmission autosomique dominante L’allèle muté est typiquement hérité d’un parent atteint. Les enfants ont un risque de 50 % d’être atteints par la maladie (figure 5). Cependant, dans le cas de l’érythrodermie congénitale ichtyosiforme bulleuse, les mutations de la kératine 1 ou 10 sont souvent sporadiques et identifiées de novo (figure 6). Cette maladie bulleuse se présente sous l’aspect d’un « enfant brûlé » à la naissance, dont la peau devient ensuite hyperkératosique. La maladie est rare et sévère : la kératodermie est très importante et sa mauvaise odeur limite la vie sociale des patients et leur procréation. Un diagnostic prénatal est possible pour les mutations des kératines 1 et 10. Transmission dominante liée au sexe L’allèle muté chez les femmes se trouve sur le chromosome X. L’image clinique montre une disposition blaschkoïde sectorielle avec une atteinte correspondant aux zones où l’allèle normal de l’X est inactivé (figure 7). En conséquence, les mères touchées ont 50 % de chance de transmettre l’allèle normal et 50 % des filles sont atteintes. Notre exemple rarissime est celui de l’ichtyose dominante liée à l’X associée à une chondrodysplasie ponctuée et parfois à des cataractes (figure 8). La maladie est létale chez les garçons et est due à un défaut de la biosynthèse du cholestérol. La clinique est très typique avec une érythrodermie congénitale ichtyosiforme sèche et de fines hyperkératoses folliculaires en lignes, qui se développeront plus tard en atrophodermie folliculaire. Les anomalies osseuses asymétriques sont souvent majeures. Le diagnostic est confirmé par la radiographie et la biopsie cutanée qui révèlent des calcifications osseuses et épidermiques folliculaires. Un dosage biochimique des précurseurs du cholestérol et l’analyse moléculaire de confirmation (gène EBP) sont également disponibles. Transmission autosomique semi-dominante Figure 6. Érythrodermie congénitale ichtyosiforme bulleuse. Figure 7. Transmission dominante liée au sexe. Un ou deux allèles mutés sont hérités d’un ou des deux parents touchés (figure 9). Chaque allèle muté contribue en proportion à la manifestation clinique. Lorsque les deux parents sont hétérozygotes, les enfants portent un risque de 25 % de souffrir d’une maladie sévère et de 50 % de souffrir d’une forme plus légère (causée par l’hétérozygotie). Il s’agit du mode de transmission très longtemps ignoré de l’ichtyose vulgaire. Celle-ci est fréquente et se présente sous deux formes majeures : la forme classique d’une fréquence de 1/400 est causée par l’atteinte des 2 allèles de la profilaggrine, codant pour la protéine constituant les granules de kératohyaline. La forme légère et commune est due à l’atteinte d’un seul allèle (à l’état hétérozygote) et touche 10 % environ de la population européenne. Cette forme se présente souvent comme une « xérose » cutanée et se manifeste particulièrement en hiver et en climat sec. Il existe une grande variabilité clinique et morphologique qui s’explique probablement par des mutations non encore identifiées situées à l’intérieur des 10 à 12 unités de filaggrine contenues dans le gène de la profilaggrine. L’ichtyose vulgaire légère et commune touche 10 % environ de la population européenne. Figure 9. Transmission autosomique semi-dominante. Figure 8. Erythrodermie ichtyosiforme et chondrodysplasie dominante liée au sexe. L’association fréquente – estimée à 35-50 % – de l’ichtyose vulgaire avec différentes formes d’atopie (eczéma atopique, asthme bronchique, rhinite allergique) fait de la profilaggrine un facteur prédisposant majeur aux maladies atopiques. Cette donnée est actuellement de première importance pour le pédiatre et le médecin généraliste. Cliniquement, l’ichtyose vulgaire se manifeste dans la première ou deuxième année et persiste ensuite toute la vie. Son expression varie des formes minimes (hétérozygotes), surtout localisées à la face d’extension des jambes, à des formes complètes (homozygotes ou hétérozygotes composites). L’ichtyose vulgaire atteint surtout les faces d’extension des membres de façon symétrique. Dans la plupart des cas, il n’existe qu’une légère xérodermie sur le visage avec les lignes des lèvres de Parrot accentuées. Le cuir chevelu est légèrement pityriasique. Les grands plis sont respectés : ce signe est un critère clinique important de diagnostic différentiel avec les érythrodermies congénitales ichtyosiformes et l’ichtyose lamellaire. Les paumes sont sèches avec exagération des plis palmaires (figure 10) contrairement à l’ichtyose récessive liée à l’X où elles sont normales. L’importance de l’atteinte palmaire est un excellent signe clinique pour discriminer les deux formes d’ichtyose vulgaire causées par la mutation des deux ou d’un seul allèle du gène de la profilaggrine. L’ichtyose vulgaire s’aggrave en hiver et s’améliore spontanément en été et dans les climats humides. Une kératose pilaire est souvent associée sur les faces d’extension des bras et des cuisses et sur les fesses. L’ichtyose vulgaire est due à la transmission autosomique semidominante d’un ou deux allèles mutés de la profilaggrine. Le conseil génétique Figure 10. Ichtyose vulgaire. Quand le diagnostic est posé, on explique au patient exactement la nature, les conséquences et le mode de transmission de la maladie. Nous incitons toujours les patients à communiquer ces éléments à leurs apparentés et restons à disposition pour un conseil génétique. Par exemple, un couple dont le frère de la femme est atteint d’ichtyose lamellaire de type 1 veut connaître le risque pour son futur enfant. Il est d’abord important de s’assurer du diagnostic posé, qu’il n’existe pas de consanguinité entre les deux membres du couple et de vérifier l’absence d’antécédent d’affection similaire dans la famille du conjoint. La fréquence de la maladie est 1 sur 250 000 personnes dans la région d’origine. En conséquence, la fréquence de(s) l’allèle(s) muté(s) est de 1 sur 500 et la fréquence des hétérozygotes dans la population générale peut être estimée à 1 sur 250. En fonction de l’anamnèse familiale, la mère du foetus a un risque de 2 sur 3 d’être hétérozygote et le risque pour son enfant est de 1 sur 1 500. Pour cette raison, il faut résister à négliger, voire à exclure, tout risque de récurrence, particulièrement pour les maladies récessives rares. Dans tous les cas, nous proposons une consultation spécialisée en dermatologie génétique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :