Publié le 02 mai 2011Lecture 9 min
Actualités en physiopathologie du vieillissement cutané
Y. GALL, Service de dermatologievénéréologie, CHU de Toulouse
Le vieillissement cutané s’exprime à la surface de la peau par des modifications cliniques visibles qui sont sous-tendues par des altérations histologiques et biochimiques progressives. Celles-ci sont secondaires à la combinaison de facteurs génétiques et de facteurs environnementaux qui s’associent au cours du temps (1). La peau, située à l’extérieur de l’organisme, se trouve particulièrement exposée aux agressions radicalaires de l’environnement (UV, pollution, détergents, etc.). Le photovieillissement (figure 1) est le principal témoin de ces agressions répétées : rides, taches dyschromiques, parfois carcinomes apparaissent sur les zones exposées. La peau perd sa souplesse et se fragilise (cicatrices stellaires, purpura de Bateman).
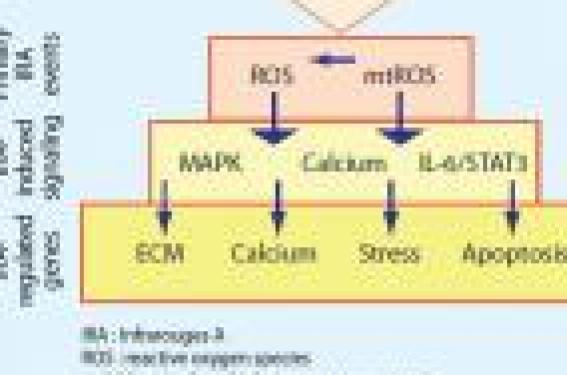
Les connaissances les plus récentes concernent essentiellement : – le rôle du stress oxydatif induit par les radiations solaires répétées ; – les modifications de la fonction barrière et de la composition lipidique de surface et des espaces intercellulaires ; – l’impact des métalloprotéinases (MMP) sur la dégradation de la matrice extracellulaire ; – le rôle des rayons solaires dans l’altération des protéines sécrétées par les kératinocytes et les fibroblastes ; – les connaissances sur le contrôle génétique. Les facteurs d’agression chronique du revêtement cutané • Les UV agissent différemment sur la peau selon qu’il s’agit des UVB ou des UVA. Les premiers sont plus énergétiques et produisent des lésions directes de l’ADN alors que les UVA (qui sont 1 000 fois moins puissants) agissent par l’intermédiaire de la libération de radicaux libres. Les UVA représentent 70 % du rayonnement journalier reçu par la peau. • Les radicaux libres produits sous l’influence des UVA sont : l’oxygène singulet (1O2), l’anion superoxyde (O2°), le peroxyde d’hydrogène (H2O2) et le radical hydroxyl (°OH). Ils agissent sur de nombreuses cibles biologiques : acides aminés des protéines, bases de l’ADN, acides gras insaturés des membranes cellulaires, etc. Les ions métalliques (fer, cuivre) jouent un rôle activateur des phénomènes. • Les infrarouges A (760-1 440 nm) sont impliqués dans la dégradation de la matrice extracellulaire (MEC), l’homéostasie calcique, les voies de signalisation du stress et l’apoptose (figure 1). Figure 1. Implication des infrarouges dans la dégradation de la matrice extracellulaire, les voies de signalisation du stress et l’apoptose. Ils agissent essentiellement en induisant la production de radicaux oxygénés par la mitochondrie (2). • Les espèces réactives de l’oxygène (ROS) provoquent des phénomènes de peroxydation lipidique en réagissant avec les acides gras polyinsaturés, les phospholipides membranaires et les lipoprotéines, qui entraînent des dommages architecturaux des membranes cellulaires (avec changement de fluidité des membranes cellulaires, inactivation des récepteurs et des enzymes membranaires), ainsi que des dommages chimiques aux protéines : production de malonedialdéhyde (MDA) et de lipofuscines. Le MDA a une grande réactivité et les lipofuscines sont des pigments fluorescents qui se déposent dans les cellules en voie de sénescence. • Les facteurs de pollution (ozone, fumée de cigarette, benzo [a] pyrène, etc.) aggravent de façon synergique les effets des UV. Lorsqu’une exposition à l’ozone précède une irradiation UV, la déplétion en vitamine E du stratum corneum s’en trouve accrue (3). de surface de l’acide urocanique, bon scavenger des radicaux oxygénés, augmente après une exposition solaire. Sa concentration diminue au cours des saisons peu ensoleillées et avec l’âge. • L’eumélanine intervient dans la protection solaire non seulement par la pigmentation mais aussi en captant les radicaux libres et en induisant la réparation des photoproduits. Il existe plus de 70 variants du récepteur de l’αMSH (Melanine Stimulating Hormone) appelé MCR1 (Melanocortin Receptor 1) : certains sont associés à un risque accru de photovieillissement et de cancers cutanés (4). Modifications des propriétés de surface Le film hydrolipidique de surface est modifié dans la peau âgée quantitativement et qualitativement. Les taux d’acides gras libres, de triglycérides et de squalène sont significativement diminués (figure 2). Figure 2. Diminution du taux des acides gras libres (A) et des triglycérides (B) dans la peau âgée protégée (fesse) par rapport à la peau âgée non protégée (avant-bras). Figure 3. Élastose solaire sous-épidermique et remaniement collagénique, caractéristiques du photoviellissement. Parmi ceux-ci, l’acide linoléique (18:2), seul à être polyinsaturé, diminue de 40 % du fait de sa vulnérabilité à l’oxydation, mais les acides mono-insaturés, comme l’acide oléique (18:1) et l’acide palmito-oléique (16:1), baissent aussi nettement. • On sait que les acides gras libres et les triglycérides jouent un rôle dans l’inhibition de certaines métalloprotéinases et de certaines cytokines inflammatoires (COX2, IL-1β). Leur diminution sous l’effet des UV (5) laisse le champ libre aux MMP qui induisent l’élastose solaire. La quantité de lipides intercornéocytaires diminue progressivement avec l’âge : près de 30 % au niveau de la face, des mains et des jambes. Ce sont les stérols et les triglycérides qui baissent le plus. • Les céramides, produits à partir des sphingomyélines, permettent la mise en place des bicouches lipidiques et assurent la fonction barrière. Ils sont abaissés dans la peau âgée du fait de la diminution des enzymes de synthèse (sphingomyélinases et céramides synthases) alors que les enzymes de dégradation (acide céramidases) restent au même niveau d’activité. Le film hydrolipidique de surface de la peau se modifie quantitativement et qualitativement au cours du vieillissement. • Parallèlement, le taux de sécrétion sébacée diminue lui aussi progressivement au cours des années, contribuant à une plus grande sécheresse cutanée et à une sensibilité accrue aux détergents. • Les protéines de l’enveloppe cornéocytaire et les acides aminés libres impliqués dans les facteurs d’hydratation (NMF) deviennent plus hydrophobes, perdant une partie de leur capacité de fixation des molécules d’eau. La quantité d’eau libre augmente (6), expliquant la tendance à la peau sèche et au prurit. Figure 4. Visualisation en échographie de la bande hypoéchogène sous-épidermique correspondant à l’élastose solaire. • Il existe aussi une diminution de prolifération des kératinocytes et une baisse de leur réponse aux facteurs de croissance et de signalisation cellulaire favorisant la fragilité cutanée et les retards de cicatrisation. Le rôle des métalloprotéinases Ce sont des enzymes impliquées dans la dégradation et le renouvellement de certaines protéines du derme et de l’épiderme. On distingue des collagénases (MMP-1), des stromélysines (MMP-3) et des gélatinases (MMP-9). Elles dégradent les fibres de collagène et d’élastine ainsi que certaines protéines kératinocytaires et de la matrice extracellulaire. Elles sont activées via des protéines kinases qui induisent un facteur de transcription nucléaire (AP-1) contrôlant la production des MMP. L’ion fer intervient dans le métabolisme de certaines MMP comme les collagénases, non seulement via le facteur AP-1, mais aussi via NFκB (autre facteur de transcription) qui amplifie la réponse aux UV. Il induit la production de cytokines inflammatoires (IL-1, TNFα, etc.) impliquées dans l’attraction des leucocytes qui produisent d’autres MMP comme MMP-8. Il existe une corrélation directe entre le niveau d’exposition aux UV et l’induction des MMP. Des doses répétées au-dessous du seuil érythémal sont suffisantes pour maintenir un taux élevé de MMP (7). Elles dégradent progressivement les fibres dermiques (8) et sont responsables de l’élastose solaire (figure 3), que l’on peut mesurer par les techniques échographiques (figure 4). Les inhibiteurs des métalloprotéinases (TIMP) sont inhibés par les UV. La baisse du taux de collagène sous l’effet des MMP est accentuée par la diminution du pool de procollagène 1 sous l’effet conjugué de l’augmentation du facteur AP-1 et de la baisse de l’expression de TGFβ. Ici aussi, les infrarouges A sont impliqués en augmentant l’expression des enzymes responsables de la matrice extracellulaire et en inhibant directement la synthèse de collagène. L’exposition de la peau aux UV, aux IR et à la chaleur induit un chimiotactisme important des neutrophiles dans le derme où leurs enzymes protéolytiques (élastases) sont responsables de l’élastose solaire. Les métalloprotéases qui dégradent les fibres dermiques augmentent avec l’exposition solaire. Les facteurs génétiques Depuis les expériences de Hayfick, on sait que les cellules sont programmées pour un nombre limité de divisions cellulaires. Sur les chromosomes 1, 4 et 7, il existe des loci limitant le potentiel de réplication des cellules humaines normales. Figure 5. Mécanismes de protection cellulaire et de réparation après expositions solaires. Le gène impliqué dans le syndrome de Werner, localisé sur le chromosome 8, code pour une hélicase qui est responsable de la dégradation de l’ADN. L’ADN nucléaire est sujet aux mutations induites directement par les UVB et par l’intermédiaire des radicaux oxygénés en ce qui concerne les UVA. Les UVB induisent des dimères et des photoproduits. Plusieurs mécanismes sont utilisés par la cellule pour limiter les risques de carcinogenèse : apoptose, réparation de l’ADN par des réparases, mise en état de sénescence accélérée… (figure 5). Les « sunburn cells » sont des cellules apoptotiques témoignant des dégâts cellulaires induits par les UV. On les observe dans l’épiderme dès la 30e minute après irradiation solaire. Leur nombre diminue dans la peau âgée, favorisant ainsi la cancérogenèse. L’ADN mitochondrial (9) est soumis à une intense activité radicalaire car la mitochondrie intervient dans la chaîne respiratoire. Les mutations de cet ADN induisent des anomalies de la chaîne de transport des électrons. Elles s’accumulent au cours du photovieillissement et constituent un bon marqueur des facteurs de risque de kératoses actiniques et de carcinomes épidermoïdes. Certains polymorphismes de l’ADN mitochondrial sont associés à la longévité. Les télomères sont des parties répétitives situées à la fin de la molécule d’ADN. Ils assurent la stabilité de la molécule et sa bonne réplication. Les télomérases permettent leur reconstitution à la fin de la mitose, essentiellement pendant le développement foetal. Elles existent de façon transitoire dans les tissus en renouvellement comme l’épiderme. Leur activité se réduit avec l’âge expliquant le raccourcissement progressif des télomères (10). Il se produit ainsi des erreurs au cours de la réplication du matériel génétique. Dans la progéria ou le syndrome de Werner, les télomères sont raccourcis. Les mutations de l’ADN nucléaire et mitochondrial s’accumulent au cours du photovieillissement. Conclusion Les mécanismes du vieillissement cutané (programmé génétiquement) sont imbriqués à ceux du photovieillissement (dépendant des agressions extérieures). Les infrarouges et la chaleur qu’ils libèrent associent leurs effets à ceux des autres longueurs d’onde (UVB et UVA). La répétition des agressions UV induit des dégâts au niveau de l’ADN. La conception actuelle fait des signes du photovieillissement un moyen de protection contre la cancérogenèse en altérant le métabolisme cellulaire et en limitant le renouvellement des cellules endommagées. Les nouveaux outils de la bio-informatique (séquençage, plateformes de puces ADN, etc.) vont permettre une analyse plus précise de l’expression génomique des cellules cutanées soumises aux facteurs environnementaux (11).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :