Publié le 26 sep 2019Lecture 10 min
Prise en charge de la pemphigoïde bulleuse
M. ALEXANDRE, CRMR Maladies bulleuses auto-immunes (MALIBUL), Hôpital Avicenne, Bobigny
« Ou l’exercice d’équilibriste entre efficacité et iatrogénicité »
Avec le vieillissement de la population, non seulement la pemphigoïde bulleuse (PB) est en passe de ne plus être une maladie rare, mais sa prise en charge nous confronte à une double exigence : être efficace en limitant au maximum l’iatrogénicité chez ces patients souvent très âgés et fragiles.
La pemphigoïde bulleuse (PB) est une maladie du sujet âgé, avec un âge moyen entre 75 et 81 ans. L’association à des maladies neurodégénératives est fréquente (démence, accident vasculaire cérébral, maladie de Parkinson). C’est la moins rare des maladies bulleuses auto-immunes (MBAI) avec actuellement une incidence de 21 nouveaux cas par an et par million d’habitants dans la population générale. Si on ne considère que la population des plus de 80 ans, ce n’est alors plus une maladie rare avec 150 à 180 nouveaux cas/an/million d’habitant. Son incidence a considérablement augmenté (multipliée par 3 en France) durant ces 10 dernières années, vraisemblablement du fait du vieillissement de la population, mais aussi du fait de l’augmentation de la fréquence des maladies neuro logiques et de l’usage plus répandu de médicaments inducteurs (diurétiques, psychotropes, gliptines).
Diagnostic clinique
Forme typique (figure 1)
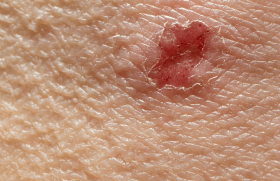
Dans sa forme typique le diagnostic pose rarement pro blème : survenue, chez le sujet âgé (plus de 70 ans), de bulles spontanées de grande taille, tendues, se développant sur une base érythémateuse, associées à des lésions urticariennes ou eczématiformes, siégeant de façon bilatérale et globalement symétrique sur les faces de flexion des membres, les plis inguinaux et axillaires, la partie basse de l’abdomen. Le nombre de bulles est très variable de moins de 10 (formes paucibulleuses) à plus de 300 (formes multi-bulleuses). Elles laissent place une fois rompues à des érosions. Elles doivent être quotidiennement comptabilisées. L’extrémité céphalique est habituellement épargnée et les lésions guérissent sans laisser de cicatrice atrophique. Le prurit, volontiers intense, est quasi constant, il précède souvent l’éruption. L’atteinte muqueuse est rare (8 % des cas) et doit pousser à évoquer un diagnostic différentiel (pemphigoïde des muqueuses, en particulier). L’hémogramme montre habituellement une hyperéosinophilie.
Formes atypiques
Les formes prébulleuses et postbulleuses : il faut savoir évoquer ce diagnostic devant des lésions chroniques aspécifiques eczématiformes ou urticariennes fixes (figure 2), des érosions arrondies, un tableau de prurigo chez un sujet âgé (figure 3) voire un prurit sine materia.
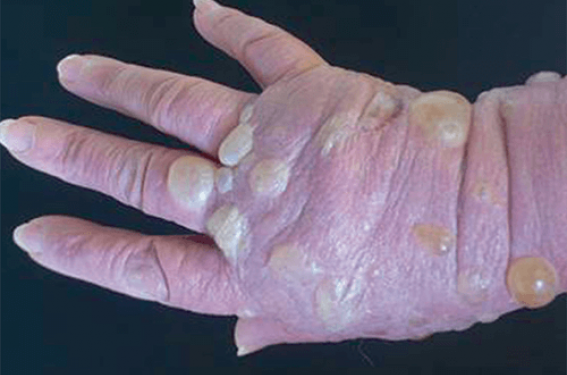
Les formes atypiques : en particulier celles localisées (formes de début, ou en zone irradiée) ou palmoplantaires dyshidrosiformes (figure 4).
Diagnostics différentiels
Les MBAI intra-épidermiques : pemphigus (herpétiforme notamment).
Les autres MBAI sous-épidermiques : pemphigoïde des muqueuses (ex-pemphigoïde cicatricielle), épidermolyse bulleuse acquise, maladie à IgA linéaire, etc.
Les maladies donnant des bulles, non auto-immunes, par exemple avec une immunofluorescence directe (IFD) négative : eczéma dans une forme bulleuse, impétigo bulleux, toxidermies bulleuses, bulles hydrostatiques, bulles de pression, bullose du diabétique…
Diagnostic paraclinique
L’histologie permet de confirmer le diagnostic de maladie bulleuse de la jonction en montrant une bulle sousépidermique contenant des polynucléaires neutrophiles et/ou surtout éosinophiles. Elle permet en outre d’identifier un éventuel infiltrat inflammatoire associé et de le caractériser : le plus souvent infiltrat dermique inflammatoire riche en éosinophiles, ou margination des polynucléaires éosinophiles le long de la jonction dermo-épidermique (JDE).
• L’IFD permet d’affirmer son caractère auto-immun en montrant des dépôts immuns linéaires à la JDE d’IgG et/ou C3. Cet examen est indispensable au diagnostic de MBAI (figure 5).
L’immunofluorescence indirecte (IFI) standard sur œsophage de rat, de singe ou peau humaine totale : retrouve des anticorps (Ac) anti-membrane basale de classe IgG, détectables dans 80 % des sérums.
L’IFI sur peau clivée par le NaCl : retrouve des Ac antimembrane basale marquant le versant épidermique (toit) du clivage.
Les tests ELISA : donnent le taux des Ac anti-BP180 NC-16A et/ou anti-BP230 (examens qualitatifs et quantitatifs).
L’immunoblot sur extrait épidermique ou extrait amniotique montre des Ac anti-BP180 NC-16A et/ou anti-BP230 (examen qualitatif). Ces examens sérologiques (IFI, immunoblot et ELISA) ne sont ni nécessaires ni suffisants pour porter le diagnostic de PB. Leur titre en IFI n’est pas corrélé ni à l’extension, ni au nombre de bulles. Les données concernant la corrélation ELISA BP180 NC16A avec l’extension et le nombre de bulles sont contra dictoires, mais il a une valeur pronostique du risque de rechute au cours du suivi(1).
Traitement classique : la corticothérapie locale forte
Pour comprendre les difficultés thérapeutiques soulevées par la PB, il est essentiel de ne pas perdre de vue qu’il s’agit d’une maladie de mauvais pronostic avec une mortalité de 20 à 40 % à 1 an, variable d’une étude à l’autre. Le mauvais état général et le grand âge sont les prin cipaux facteurs de risque de mortalité. A contrario, le pronostic est indépendant des facteurs directement liés à la PB, notamment l’extension des lésions cutanées et le nombre de bulles(3). Ces données nous permettent de comprendre qu’au cours de la PB, l’enjeu thérapeutique n’est pas uniquement de contrôler la maladie, il est surtout d’essayer de limiter l’iatrogénicité de nos traitements chez ces patients particulièrement fragiles. C’est dans cet esprit de diminution de l’iatrogénicité qu’a été construit l’essai bien connu mené par le Groupe bulles français et publié dans le New England Journal of Medicine en 2002, comparant la corticothérapie (CcT) locale forte à la CcT générale forte à 1 mg/kg/j, et qui a démontré la supériorité de la CcT locale aussi bien en termes de réduction des effets indésirables graves que de mortalité, avec une efficacité similaire voire meilleure(4) . Ainsi, le traitement de choix repose en France sur les dermocorticoïdes (DC) à forte dose pendant plusieurs mois.
Traitement d’attaque
• Le propionate de clobétasol crème : 20 à 40 g/j soit 2 à 4 tubes/j selon la corpulence du patient et le nombre de bulles au quotidien. Il doit être appliqué sur tout le corps y compris les érosions en n’épargnant que le visage, les organes génitaux et les plis (figure 6).
Les doses du traitement d’attaque peuvent être diminuées 15 jours après le contrôle de la maladie (exemple, absence de nouvelle bulle) ; le traitement de consolidation peut alors être débuté et doit être poursuivi pendant 6 à 12 mois. Aux DC doivent être associés :
des soins locaux : toilette antiseptique si surinfection, perçage et assèchement des bulles avec du nitrate d’argent en solution aqueuse, pansements gras ou siliconés sur les érosions en s’abstenant d’utiliser des pansements adhésifs du fait de la grande fragilité cutanée.
des mesures générales : prévention des complications de décubitus, lutte contre la dénutrition, compensation des pertes hydro-électrolytiques, éradication des foyers infectieux, mise à jour vaccinale… Doivent s’y associer la surveillance et le dépistage d’effets secondaires éventuels de la corticothérapie locale ou générale au long cours (diabète, hypertension artérielle, insuffisance surrénale, etc.). Par ailleurs, la qualité des soins locaux est indispensable à l’évolution favorable de la maladie. Une collaboration étroite entre le dermatologue, le médecin traitant et le personnel soignant est donc nécessaire. Des documents d’aide à la prise en charge (guide d’information sur la pemphigoïde bulleuse et les soins locaux à l’usage des personnels soignants et un carnet de suivi permettant de suivre l’application et l’efficacité du traitement) ont été réalisés par les centres de référence et sont disponibles sur le site internet du centre de référence(5) . En cas de non-contrôle (par exemple, résistance aux DC, < 5 % des cas), un traitement immunosuppresseur (méthotrexate, mycophénolate mofétil ou azathioprine) peut être proposé. La place du rituximab reste pour l’instant à préciser. Par ailleurs de nouveaux traitements, notamment biologiques pourraient voir le jour dans l’avenir : anti-IgE (voir plus loin) et anti-IL17 en particulier.
Traitement de consolidation
Il débute 15 jours après le contrôle de la maladie. En cas de traitement par DC, le nombre de tubes de propionate de clobétasol défini au départ reste le même mais la fréquence des applications diminue progressivement.
De quotidiennes elles passent à :
1 jour/2 pendant 1 mois ;
puis 2 fois/semaine pendant 1 mois ;
puis 1 fois/semaine pour une durée totale de 6 à 12 mois.
Arrêt du traitement
Il peut être décidé à l’issu du traitement de consolidation. La négativation de l’ELISA BP180 NC-16A et de l’IFD en peau antérieurement lésée minimisent le risque de rechute à l’arrêt(1).
Un test au synacthène est recommandé en fin de traitement. En cas de rechutes itératives, (par exemple une dépendance aux DC fréquente), les mêmes immunosupresseurs (méthotrexate, mycophénolate mofétil ou azathioprine) peuvent être proposés ainsi que les tétracyclines à visée d’épargne cortisonique.
Alternatives thérapeutiques
La corticothérapie générale à doses modérées (0,5 mg/kg/j de prednisone). Si l’iatrogénicité de la corticothérapie générale forte dose (1 mg/kg/j) est bien établie, les choses sont moins claires concernant la CcT générale à dose plus faible (0,5 mg/kg/j), volontiers utilisée par nos voisins européens arguant qu’il s’agit là d’une option simple, peu coûteuse, efficace et raisonnablement iatrogène. Le Groupe bulles français a tout récemment cherché à l’évaluer au cours d’une étude observationnelle menée sur 200 PB. Les résultats précis seront prochainement disponibles mais il apparaît en première analyse que si la CcT à 0,5 mg/kg/j semble une option acceptable dans la PB paucibulleuse, elle semble insuffisante pour les PB ayant plus de 10 bulles/j avec moins de la moitié des patients contrôlés à la 4e semaine, une mortalité à 1 an de plus de 30 %, et plus de deux tiers des patients pour qui est finalement instauré un autre traitement en cours de suivi.
Le méthotrexate (MtX) en 1re intention. On savait cette molécule utile en traitement de recours pour les PB corticorésistantes ou corticodépendantes. Elle a maintenant été évaluée en 1re intention au cours d’un essai du Groupe bulles français dont les résultats ont été présentés aux JDP 2017. Cet essai comparait la CcT locale classique poursuivie 9 mois à une CcT locale courte de 4 à 6 semaines associée à du méthotrexate (MTX) à faible dose (10 à 12,5 mg/sem). Les inclusions ont été longues, du fait de nombreux patients non éligibles à un traitement par MTX, ce qui d’emblée positionne le MTX comme une molécule qui ne pourra pas être utilisée chez tous les patients. Néanmoins pour les patients éligibles, il ressort de cet essai que le MTX en 1re intention dans la PB permet un contrôle similaire à celui de la CcT locale forte et prolongée, un taux de rechutes diminué et donc plus de patients en rémission à M9. Par ailleurs, l’essai suggère que les 4 à 6 semaines de CcT locale forte sont un peu insuffisantes et qu’une durée un peu supérieure est souhaitable pour éviter des rechutes précoces (temps nécessaire au MTX pour être pleinement actif). Le MTX pose néanmoins des problèmes de tolérance qui devront probablement le faire réserver à des patients en bon état général.
Les tétracyclines en 1re intention. En 2017, les résultats d’un essai randomisé sans insu sur les tétracyclines en 1re intention dans la PB mené au Royaume-Uni et en Allemagne, comparant chez 256 PB la CcT générale (0,5 mg/kg/j) à la doxycycline (200 mg/j) avec autorisation d’une CcT locale ponctuelle limitée aux lésions sans dépasser 30 g/semaine ont été publiés dans le Lancet(6). Le succès était évalué à 6 semaines, défini de manière peu stricte par la présence de moins de 3 bulles/j. Ainsi, il apparaît que l’efficacité de la doxycycline à S6 était de 74 % contre 91 % dans le groupe CcT générale. Surtout, à 1 an, il y avait 2 fois moins de mortalité dans le groupe doxycycline (18 %) que dans le CcT générale (36 %), ce qui a permis aux auteurs de conclure à une non-infériorité de la doxycycline. Malgré des problèmes méthodologiques de cette étude, on peut néanmoins retenir que l’efficacité des tétracyclines est limitée mais avérée dans la PB, et que du fait de leur faible iatrogénicité elles peuvent avoir une place chez les patients très fragiles.
L’omalizumab
L’omalizumab (OMZ) est un anticorps (Ac) monoclonal anti-IgE ayant l’AMM dans l’asthme et l’urticaire chronique. La pathogénicité des IgE au cours de la PB a été démontrée sur des modèles murins mais aussi chez des patients. Cette molécule a donc été essayée dans la PB. On retrouve une petite série de 6 cas dans la littérature (7): 3 en 1re intention, 3 chez des patients en échec de CcT + immunosuppresseurs (IS). Dans 5/6 cas, l’OMZ a été très efficace, permettant d’obtenir une rémission complète, avec de manière intéressante dans la moitié des cas une efficacité spectaculairement rapide et une excellente tolérance. On retrouve également un cas clinique avec une efficacité similaire, et nous avons l’expérience dans notre service de 7 PB résistantes aux traitements précédemment entrepris traitées avec succès et rapidité par OMZ. Ainsi l’OMZ, pourrait avoir l’intérêt d’une efficacité rapide dans les PB en situation de corticorésistance, là où le délai d’action des IS rend parfois les choses difficilement tenables. Il présente par ailleurs un très bon profil de tolérance du fait de sa sélectivité anti-IgE qui n’induit pas d’immunodépression, particulièrement utile chez les patients fragiles. Son intérêt risque néanmoins d’être limité aux patients avec hyperéosinophilie et hyper-IgE importante, mais cela reste à étudier.
En conclusion, l’arsenal thérapeutique au cours de la PB a tendance à s’enrichir. L’avenir est à proposer des guidelines adaptées aux différents profils de patients. Ainsi, on pourrait imaginer que la corticothérapie locale forte reste le traitement de référence mais qu’on puisse proposer également : du MTX aux sujets avec PB sans comorbidité et en bon état général, une corticothérapie générale à faible dose à ceux avec PB pauci-bulleuses ou institutionnalisées, des tétracyclines aux patients avec PB particulièrement fragiles et enfin de l’OMZ chez ceux avec une PB corticorésistante.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :