Publié le 30 mar 2022Lecture 8 min
Le psoriasis dans tous ses états
Michèle DEKER, Neuilly-sur-Seine
Dans les formes de psoriasis autres que le psoriasis en plaques, les traitements disponibles ont encore un faible niveau de preuve. Cependant, la prise en charge est en train d’évoluer grâce aux progrès thérapeutiques.
Psoriasis paradoxal sous anti-TNF
La survenue d’un psoriasis paradoxal est possible sous anti-TNF alpha, quelle que soit la molécule. Il existe des facteurs génétiques de prédisposition (IL-23R signal reduction SNIP). La fréquence du psoriasis paradoxal est relativement élevée, soit 1 à 5 pour 100 patients/an. Le risque de récurrence est d’environ 50 % avec un autre anti-TNF, ce qui limite les possibilités de réintroduction. Le délai de survenue est variable (1-30 mois), mais la majorité survient dans les 6 premiers mois.
La première présentation clinique est le psoriasis/eczéma overlap, soit un phénotype clinique entre ces deux dermatoses, caractérisé par une atteinte des plis, du scalp, de l’ombilic, des lésions eczématiformes et une colonisation par des staphylocoques.
La deuxième est un psoriasis généralisé, éventuellement paradoxal inflammatoire, ou un psoriasis en gouttes voire du scalp, possiblement décalvant. La troisième est le psoriasis palmo-plantaire en plaques ou pustuleux.
Ces formes de psoriasis paradoxal peuvent toucher des patients traités pour une maladie rhumatologique, gastroentérologique, en médecine interne, en pédiatrie.
En pratique, la prise en charge diffère selon la sévérité :
en cas de psoriasis sévère (grade 2), changement de classe thérapeutique (ustékinumab, guselkumab) ;
en cas de psoriasis léger à modéré (classe 1), poursuite de l’anti-TNF ou changement de molécule dans la même classe : traiter la colonisation staphylococcique et l’eczéma (dermocorticoïdes, antibiotiques, ciclosporine), traiter un psoriasis pustuleux (topique : méthotrexate associé à l’anti-TNF).
Exceptionnellement, on peut associer anti-TNF et anti-IL-12/23.
Quand on analyse les lésions de psoriasis paradoxal, on découvre une signature moléculaire interféron similaire à celle du lupus et du lichen. L’interféron alpha est produit par les cellules dendritiques cutanées dont l’activité est contrôlée par le TNF. L’inhibition du TNF active les cellules dendritiques qui vont produire de l’interféron et générer des lésions cutanées.
Psoriasis paradoxal sous dupilumab
Il s’agit d’une complication rare (< 1 % des patients), fréquemment de forme pustuleuse (40 % des cas), qui nécessite l’arrêt du dupilumab dans la majorité des cas et son remplacement par du méthotrexate ou un anti-JAK. Le mécanisme est mal connu. On peut caractériser la dermatite atopique en une forme extrinsèque (Th2), associée à des sensibilisations Th2-dépendantes (asthme, rhinite allergique, hyperéosinophilie), et une forme intrinsèque associée au niveau de la peau à une réponse Th1 et Th17. Dans ce dernier cas, l’inhibition de la voie Th2 peut accentuer la réponse Th1/Th17, de phénotype psoriasis.
Psoriasis érythrodermique
Les recommandations françaises proposent, en première intention, l’acitrétine ou le méthotrexate et, en deuxième intention, un anti-TNF, l’infliximab ou l’ustékinumab, ou un anti-IL-17. Des données récentes montrent des résultats très prometteurs et d’une rapidité d’action inégalée, avec l’ixékizumab ; le guselkumab et le risankizumab sont également intéressants dans cette indication. En l’absence de comorbidités et d’urgence thérapeutique, on peut choisir le méthotrexate ou la ciclosporine ; en présence de comorbidités et d’urgence thérapeutique, les «zumab » sont préférables.
Psoriasis en gouttes
Cette forme de psoriasis a une forte connotation génétique et survient souvent après un important stimulus infectieux (streptocoque, Covid, vaccination anti-Covid). Le psoriasis en gouttes est associé à une réponse interféron alpha/Th1/Th17 dans la peau. Il peut être transitoire ou inaugural d’un psoriasis en plaques, sans que l’on connaisse les facteurs prédictifs des poussées. Le début d’un psoriasis est associé à la présence de lymphocytes mémoire, qui produisent des cytokines responsables de la récidive en cas de stimulus extérieur. Il n’y a pas d’argument pour proposer un traitement anti-infectieux ou une amygdalectomie.
Le traitement peut faire appel aux UVB TH01, au méthotrexate ou à la ciclosporine. Quand introduire une biothérapie ? Certaines études ont montré une rémission au long cours après traitement par guselkumab, ce qui suggère la possibilité de traiter rapidement par biothérapie les psoriasis en gouttes inauguraux pour modifier le cours de la maladie. L’étude GUIDE est en cours avec le guselkumab ; les patients totalement blanchis au bout de 24 semaines recevront différents régimes de guselkumab (toutes les 8 semaines ou 16 semaines) afin d’évaluer le maintien de la rémission, au-delà de l’arrêt du traitement. Les résultats intermédiaires de cette étude montrent que le comportement du psoriasis diffère selon son ancienneté : les sujets ayant un psoriasis récent (< 2 ans) ont plus de chances d’être super répondeurs au traitement, et le délai de la réponse est beaucoup plus rapide.
Les recommandations européennes estiment que, en présence d’un psoriasis sévère, on peut utiliser un des traitements biologiques ayant une AMM en première intention (adalimumab, brodalumab, certolizumab, guselkumab, ixékizumab, risankizumab, sécukinumab, tildrakizumab), ce qui devrait faire évoluer les recommandations françaises.
Psoriasis palmoplantaire non pustuleux
La difficulté est double : parfois d’ordre diagnostique et surtout thérapeutique, car il s’agit d’une forme plutôt résistante. Le diagnostic est facile lorsqu’un psoriasis en plaques est associé ; en son absence, il faudra le différencier de nombreux autres diagnostics.
La prise en charge de cette localisation invalidante et douloureuse commence par des traitements locaux (dermocorticoïdes forts, souvent sous occlusion, dérivés de la vitamine D). Cependant, un traitement systémique s’avère souvent nécessaire, comme dans le psoriasis en plaques, selon les recommandations françaises.
Selon les recommandations générales européennes, pour obtenir un PASI 90, les anti-IL-17, les anti-IL-23 (à l’exception du tildrakizumab) et l’infliximab font clairement mieux que l’ustékinumab ou l’adalimumab, eux-mêmes supérieurs au certolizumab et à l’étanercept.
Psoriasis palmoplantaire pustuleux
Cette variété particulière de psoriasis est aujourd’hui désignée sous le terme de pustulose palmoplantaire : présence de pustules acrales depuis plus de 3 mois au niveau des paumes et des plantes, stériles et macroscopiquement visibles, associées ou non à un psoriasis vulgaire. Les manifestations plantaires sont parfois présentes sous la forme de croûtes un peu cuivrées, enchâssées dans le derme, sur un fond érythémato-squameux. Certaines formes frustes peuvent être difficiles à reconnaître.
La ciclosporine est le traitement ayant le meilleur niveau de preuve, permettant une rémission complète dans environ 50 % des cas. En revanche, les biothérapies sont décevantes. Seul le guselkumab (anti-IL-23) a fait la preuve d’une efficacité modérée, avec une bonne tolérance. Deux autres biothérapies, l’anakinra (anti-IL-1) et l’imsidolimab (anti-IL-36R) sont en cours d’évaluation.
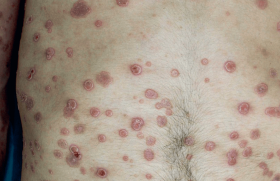
Psoriasis pustuleux généralisé
Il est caractérisé par l’apparition brutale d’un érythème inflammatoire généralisé qui se recouvre par vagues de pustules stériles, suivies de desquamation. Une asthénie profonde, une fièvre élevée et une hyperleucocytose à polynucléaires neutrophiles accompagnent le tableau clinique. Les critères diagnostiques comprennent, outre les manifestations cliniques, des pustules spongiformes à l’histologie, et des signes biologiques (leucocytose, accélération de la VS, augmentation de la CRP, des IGG ou des IgA, hypoprotéinémie, hypocalcémie). Trois grands types cliniques sont reconnus : poussée unique, poussées récurrentes compliquant un psoriasis vulgaire, ou poussées récurrentes sans psoriasis résiduel entre les poussées. Un déficit génétique en antagoniste du récepteur de l’IL-36 (DITRA) a été mis en évidence dans cette dernière forme. La maladie s’accompagne d’atteintes extracutanées variées, et parfois d’une atteinte pulmonaire qui en fait toute la gravité.
Le traitement doit être rapidement institué : ciclosporine ou acitrétine à forte dose ou infliximab. Une nouvelle biothérapie devrait s’y ajouter : le spesolimab, anti-IL-36R (non encore commercialisé).
Psoriasis génital
Cette localisation est globalement sous-diagnostiquée comme le révèle l’étude GENIPSO dans laquelle 43 % des atteintes cutanées s’accompagnaient de lésions génitales ; seulement 40 % des patients avaient déjà eu un examen génital. Le prurit est le maître symptôme des atteintes génitales.
La prise en charge associe des traitements locaux (dermocorticoïdes forts/très forts, vitamine D topique, tacrolimus topique) et des traitements systémiques (méthotrexate, acitrétine, ciclosporine, aprémilast). Les biothérapies sont rapportées efficaces, mais la hiérarchisation est difficile (anti-TNF alpha, ustékinumab, anti-IL-17, anti-IL-23). Étant donné le fort impact de la maladie il ne faut pas hésiter à commencer un traitement systémique.
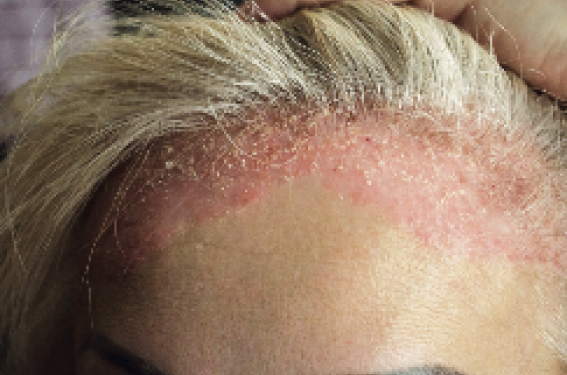
Psoriasis du cuir chevelu
Il est fréquent (> 50 % des psoriasis cutanés), très prurigineux (> 90 % des cas). Le traitement topique associant dermocorticoïdes et vitamine D serait un peu supérieur aux dérivés de la vitamine D seuls. Parmi les traitements systémiques, le méthotrexate vient en premier, suivi de l’acitrétine et de la ciclosporine; l’aprémilast a montré dans une étude qu’il est efficace versus placebo. Une biothérapie peut être envisagée si nécessaire, mais il existe peu de données dans cette localisation permettant de hiérarchiser les choix thérapeutiques.
Le psoriasis du cuir chevelu survenant sous biothérapie est assez brutal, diffus et alopéciant. Il représente une vraie urgence thérapeutique, nécessitant un changement de traitement.
Psoriasis unguéal
Cette pathologie très fréquente, à ne pas négliger pour son impact fonctionnel majeur, est statistiquement associée au rhumatisme psoriasique (onycholyse, lignes de Beau en particulier). L’atteinte cutanée précède le rhumatisme psoriasique dans 84 % des cas avec une durée médiane de développement de 12 ans.
La prise en charge doit être pensée de manière globale. Le traitement des causes externes est la clé de voûte de la prise en charge : découpe systématique de l’onycholyse ; lutte contre la macération (porter des gants voire une double paire, limiter les lavages des mains, éviter de laver la vaisselle, attention au découpage des légumes et des fruits) ; lutte contre le phénomène de Koebner.
Les dermocorticoïdes d’activité très forte sont à utiliser avec parcimonie en raison du risque d’atrophie et de lyse de la phalange distale. Les associations dermocorticoïdes et vitamine D topique sont indiquées en expliquant la technique d’application (massages réguliers en regard de la matrice et du lit de l’ongle). Des injections de corticoïdes sont possibles lorsque le nombre d’ongles à traiter est limité (≤ 3) : triamcinolone 10 mg/ml, toutes les 3-8 semaines, avec un risque d’effets secondaires. Des injections de méthotrexate (2,5 mg/ml toutes les 6-8 semaines) sont possibles mais non évaluées. Parmi les traitements systémiques, le méthotrexate vient en première intention, sinon l’acitrétine ou la ciclosporine. Le traitement biologique est licite étant donné l’impact de la maladie, mais la réponse est plus lente (évaluation à 6 mois) ; la hiérarchisation des molécules est difficile.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :