Maladie de système, Médecine interne
Publié le 31 aoû 2006Lecture 12 min
Traitement des lésions anopérinéales au cours de la maladie de Crohn
N. Munoz-bongrand, M. Allez, M. Lemann (Hôpital Saint-Louis, Paris)
Le traitement des lésions anopérinéales (LAP) au cours de la maladie de Crohn (MC) est souvent complexe, avec une variété d’options thérapeutiques, justifiant une prise en charge multidisciplinaire. Nous vous proposons une revue de détail des options thérapeutiques et de leurs indications.
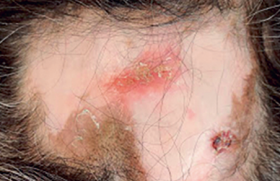
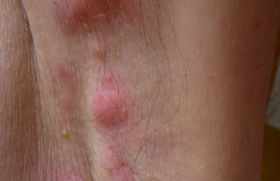
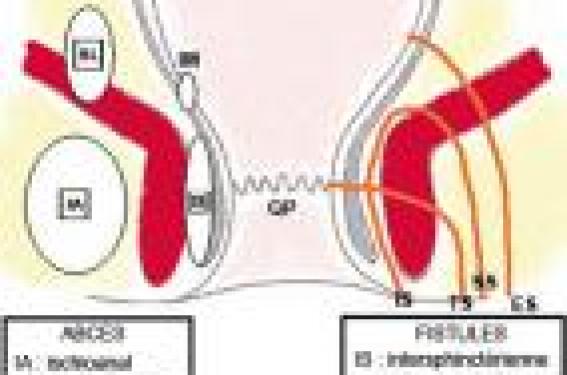
Près d’un patient sur deux présente des LAP au cours de l’évolution de sa maladie. Dans une étude de population, le taux de fistule périnéale était voisin de 20 % à 20 ans. Elles sont d’autant plus fréquentes que la maladie est plus distale sur l’intestin. Les conséquences des LAP sont potentiellement sévères avec un risque d’incontinence variant entre 11 et 39 %. Figure 1. Classification des abcès et fistules périanaux en fonction de leur localisation par rapport à l’appareil sphinctérien (OP : orifice primaire). Cause et classification des LAP Les patients atteints de MC peuvent avoir une variété de manifestations périnéales, incluant des lésions cutanées périanales, des lésions du canal anal (fissures, ulcérations, sténoses), des fistules périanales et des abcès, des fistules rectovaginales et, beaucoup plus rarement, des cancers. Les fistules périanales peuvent débuter par une infection ou une inflammation des glandes anales et/ou plus souvent, par des fissures ou des ulcérations du rectum ou du canal anal. Plusieurs classifications des LAP ont été proposées, dont la classification UFS de Cardiff permettant une description analytique des lésions. Fissures et ulcérations anales Elles peuvent être superficielles, mais sont le plus souvent profondes, atones, confluentes, parfois délabrantes, débordant sur la peau périanale. Abcès anaux Leur symptomatologie est le plus souvent classique (tuméfaction, douleur, fièvre, érythème), mais la simple apparition de proctalgies chez un patient porteur ou non de LAP doit faire suspecter ce diagnostic et poser l’indication d’un examen proctologique sous anesthésie générale. Leur localisation est définie par rapport à l’appareil sphinctérien (figure 1). Fistules anales Elles sont souvent révélées par un abcès périanal. Elles sont définies : – par leur situation par rapport à l’appareil sphinctérien (figure 1), – par leurs orifices d’entrée (le plus souvent anal) et de sortie (cutané ou vulvaire), – et par leur caractère simple (trajet unique et bas) ou complexe (trajets multiples et hauts). Elles peuvent être productives avec émission régulière de matériel purulent, mais aussi par passage de gaz ou de selles. Comme pour les abcès, leur trajet est précisé lors d’un examen sous anesthésie générale, mais l’IRM ou l’échoendoscopie préopératoires permettent d’orienter l’exploration. Sténoses anorectales Elles peuvent être courtes, en diaphragme, ou plus longues. Elles compliquent respectivement la cicatrisation d’ulcérations ou l’évolution chronique d’une suppuration périanale. Le bilan des lésions L’interrogatoire cherche l’existence de signes fonctionnels (douleurs, écoulement, etc.). L’examen physique de la région périanale, par un déplissement de la marge en décubitus latéral, permet d’identifier les pseudo-marisques, les fissures anales, les fistules périanales et les collections (abcès). Le toucher rectal, non indispensable et souvent douloureux sans anesthésie, peut mettre en évidence une sténose anale ou rectale. Cette première évaluation (examen physique et endoscopie) permet souvent de distinguer les fistules « simples » des fistules « complexes ». Évaluation des fistules complexes ou récidivantes Un bilan par imagerie peut être utile dans l’évaluation des lésions suppuratives (abcès et fistules), permettant de repérer le (ou les) trajet(s) fistuleux, leur(s) orifice(s) primaire(s) et secondaire(s), et leurs rapports anatomiques, en particulier avec l’appareil sphinctérien. L’examen sous anesthésie générale est souvent nécessaire. Il a l’avantage de faire le bilan et le drainage des lésions dans le même temps. L’IRM et l’échoendoscopie ont une valeur diagnostique équivalente, la combinaison avec l’examen sous anesthésie générale permettant une meilleure évaluation des LAP complexes. L’IRM et l’échoendoscopie ont une bonne sensibilité pour la détection des abcès. Lorsqu’un traitement médical est envisagé sans drainage chirurgical préalable (avec, par exemple, un traitement par infliximab), l’IRM et l’échoendoscopie ont une bonne sensibilité pour la détection des abcès. L’examen sous anesthésie générale doit être associé à un examen endoscopique du rectum, afin d’évaluer les lésions du bas rectum et dans certains cas d’aider le chirurgien à trouver l’orifice primaire. L’examen comprend une inspection, la palpation et l’exploration des trajets fistuleux par sondes malléables et injection de bleu de méthylène. Traitement médical Différents agents thérapeutiques ont une efficacité certaine ou probable dans le traitement des LAP de la MC : les antibiotiques, l’azathioprine (AZA) et la 6-mercaptopurine (6MP), l’infliximab, la ciclosporine et le tacrolimus. Ces différents traitements, en dehors des antibiotiques, ne peuvent être envisagés que si les lésions suppuratives sont correctement drainées. Antibiotiques Il n’existe aucune étude contrôlée concernant l’efficacité des antibiotiques dans le traitement des fistules périnéales au cours de la MC. L’utilisation habituelle de la ciprofloxacine ou du métronidazole dans cette situation repose sur des essais non contrôlés. Dans l’étude de Bernstein et al., portant sur 21 patients traités par métronidazole (20 mg/kg/j), une réponse clinique avec diminution des douleurs a été observée chez tous les sujets, avec une cicatrisation complète des lésions dans 56 % des cas (10/18). Classiquement, le métronidazole est utilisé à raison de 1 à 1,5 g/j et la ciprofloxacine à la dose de 1 g/j. Il n’y a pas de recommandations précises quant à la durée du traitement. L’utilisation du métronidazole de façon prolongée est limitée par le risque de neuropathie périphérique. Immunosuppresseurs Il n’y a pas d’essais contrôlés testant l’efficacité des analogues de la purine (AZA ou 6MP) et ayant comme objectif primaire la fermeture des orifices fistuleux. La métaanalyse de Pearson et al. sur l’efficacité de l’AZA et de la 6MP dans la maladie de Crohn a inclus 5 études portant sur 70 patients ayant des fistules et chez lesquels l’information concernant la fermeture des fistules était disponible. Cette fermeture était notée chez 54 % (22/41) des patients sous AZA ou 6MP vs 21 % (6/29) de ceux sous placebo (OR : 4,44). Même si ces chiffres apparaissent optimistes, en pratique l’AZA et la 6MP sont efficaces dans le traitement des fistules de MC. En cas d’échec ou d’intolérance à ces médicaments, un traitement par méthotrexate peut être proposé. En effet, deux essais non contrôlés récemment publiés montrent une efficacité du méthotrexate dans le traitement des fistules périnéales. Infliximab Deux essais contrôlés ont démontré l’efficacité de l’infliximab dans la fermeture des fistules périnéales de la MC. Deux essais contrôlés ont démontré l’efficacité de l’infliximab dans la fermeture des fistules périnéales de la MC. Dans l’essai de Present et al., 94 patients ayant des fistules (périnéales dans 85 cas) étaient randomisés pour recevoir 3 perfusions (aux semaines 0, 2 et 6) d’infliximab à la dose de 5 ou 10 mg/kg ou d’un placebo. La fermeture complète des fistules était obtenue chez 55 et 38 % des patients traités par infliximab (à 5 et 10 mg/kg, respectivement) versus 13 % de ceux recevant un placebo (p = 0,001 et p = 0,04, respectivement). Il faut noter que 11% des patients traités par infliximab ont développé un abcès périnéal, probablement dû à la fermeture précoce de l’orifice cutané externe, avant la fermeture du reste du trajet fistuleux. Cela souligne l’intérêt d’un drainage efficace avant le traitement par infliximab. La fermeture des fistules était temporaire dans la majorité des cas ; la durée moyenne de réponse étant de 12 semaines. L’essai Accent II a démontré l’efficacité du traitement d’entretien par infliximab dans le maintien de la fermeture des fistules. Trois cent six patients ont reçu un traitement d’induction par infliximab avec 3 perfusions. Les 195 d’entre eux (69 %) qui ont répondu au traitement (diminution du nombre de fistules productives) ont été randomisés en deux groupes recevant une perfusion d’infliximab ou de placebo toutes les 8 semaines jusqu’à la 46e semaine. La durée médiane de maintien de la réponse était significativement plus longue dans le groupe retraité par infliximab toutes les 8 semaines par rapport au groupe placebo (supérieure à 40 semaines vs 14 semaines, p < 0,001). L’infliximab est donc efficace pour le maintien de la rémission lorsqu’il a permis la fermeture des fistules. Les récidives de fistules chez les patients en échec avec les traitements conventionnels (association d’immunosuppresseurs au traitement par infliximab en induction) doivent faire discuter un traitement d’entretien au long cours par infliximab. Les sétons peuvent être retirés chez les patients répondeurs à l’infliximab, en général après 2 perfusions de l’anti-TNF. Cette ablation est probablement nécessaire à la fermeture complète des fistules. Il est parfois préférable de laisser les sétons, ce qui n’empêche pas chez certains malades la poursuite de l’infliximab. Ciclosporine, tacrolimus, thalidomide Plusieurs essais non contrôlés ont montré l’efficacité de la ciclosporine, administrée par voie intraveineuse, puis par voie orale, dans le traitement des fistules périnéales de MC. La récidive est particulièrement fréquente à l’arrêt de la ciclosporine. L’efficacité de ce traitement au long cours est probablement meilleure en association avec l’AZA ou la 6MP. Une étude contrôlée a montré également l’efficacité du tacrolimus dans le traitement des fistules périnéales de Crohn. Le thalidomide pourrait également être efficace dans cette indication, son utilisation étant limitée par ses effets secondaires. Traitement chirurgical Il vise à contrôler les phénomènes septiques locaux ou la gêne occasionnée par une fistule anale, sans retentir sur la fonction sphinctérienne. Cependant, la répétition ou la chronicisation des LAP, et la multiplication des gestes chirurgicaux majore ce risque au cours de l’évolution de la MC. Drainage des abcès Après incision sur le toit de l’abcès, une exploration au stylet et/ou au bleu de méthylène met en évidence l’orifice primaire, anal ou rectal, et d’éventuels trajets borgnes associés. Si aucun orifice d’entrée n’est trouvé, un méchage ou un module d’irrigation (pour les abcès volumineux) peuvent être laissés en place pendant quelques jours. Fistules anales La prise en charge dépend bien sûr du siège de la fistule par rapport au sphincter, mais aussi de l’état de la muqueuse anorectale. Le traitement le plus simple est le drainage en séton de la fistule, par mise en place d’un élastique ou d’un fil non résorbable de gros diamètre. Ce drain en séton doit être laissé lâche, pendant plusieurs mois. Au retrait du séton, la fermeture de la fistule se produit dans 10 à 60 % des cas, mais une récidive survient dans 15 à 60 % des cas. L’utilisation du drain en séton serré qui produit une section progressive du sphincter n’est pas recommandée dans les fistules de la MC. Quelques principes dans le traitement des LAP de la MC. • Le premier temps consiste à drainer les abcès. • La chirurgie doit préserver la fonction sphinctérienne en évitant tous les gestes traumatisants. • La chirurgie réparatrice ne peut être envisagée qu’après contrôle de l’inflammation anorectale. • La corticothérapie n’a pas sa place dans le traitement des fistules. La mise à plat du trajet fistuleux par fistulotomie s’adresse aux fistules superficielles, si la petite quantité de fibres intéressées ne retentit pas sur la continence. La répétition de ce geste peut finir par la modifier. Cette technique n’est pas indiquée dans les fistules hautes, ni dans les fistules ano- ou rectovaginales, où le risque d’incontinence ultérieure est important. Différentes techniques chirurgicales réparatrices ont été proposées pour tenter de fermer les fistules persistantes. Ces techniques n’ont de place qu’après la phase de drainage et le contrôle de l’inflammation anorectale. • La fermeture des fistules chroniques par injection de colle biologique a initialement été proposée pour le traitement des fistules non liées à une MC, avec un taux de succès de à 15 à 60 %. La continence semble peu ou pas influencée par ce traitement. Une étude prospective randomisée et contrôlée est actuellement en cours, initiée par le Groupé d’études thérapeutiques des affections inflammatoires du tube digestif (GETAID). • Parmi les solutions chirurgicales ayant été décrites, le lambeau d’avancement intrarectal est une des plus répandues. Il consiste à exciser les tissus autour de l’orifice fistuleux anal, puis de recouvrir cet orifice et la perte de substance l’entourant par un lambeau de paroi rectale. Celui-ci, muqueux, sous-muqueux et partiellement musculeux, est découpé en « U » sur 6 à 8 cm de haut dans la paroi rectale, puis glissé et suturé sur l’orifice fistuleux. Les taux de réussite vont de 50 à 80 % dans les séries de plus de 10 patients atteints de maladie de Crohn. Les résultats sont moins bons dans la maladie de Crohn que dans la population globale. Cette technique semble également efficace dans les fistules ano- ou rectovaginales. L’effet sur la continence a été rarement étudié. • Dans les fistules ano- ou rectovaginales, l’interposition dans la cloison rectovaginale d’un lambeau issu de la grande lèvre (lambeau de Martius) pourrait être une solution de rattrapage en cas d’échec des techniques précédentes. La réalisation d’une iléostomie ou colostomie de dérivation favorise la cicatrisation des LAP, qu’elles aient été opérées ou non. Cependant, chez ces patients porteurs de LAP souvent évoluées ou actives, le risque de laisser en place cette stomie initialement temporaire est important. Une proctectomie pour LAP est nécessairement une amputation abdominopérinéale ; elle ne peut être envisagée qu’en cas d’échec des autres traitements, médicaux ou chirurgicaux, lorsque les phénomènes septiques ou le retentissement sur la continence ne sont plus contrôlables.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :