Publié le 24 aoû 2006Lecture 14 min
Les immunothérapies dans le mélanome
F. Aubin, CHRU de Besançon
La mise en évidence des antigènes tumoraux du mélanome, la meilleure compréhension des mécanismes de l'immunité antitumorale et les conséquences techniques qui en découlent ont permis le développement de stratégies immunothérapeutiques dirigées contre ce terrible cancer. Ces stratégies, spécifiques ou non du mélanome, ont été testées ou sont en cours d'évaluation à travers des essais cliniques chez l'homme.
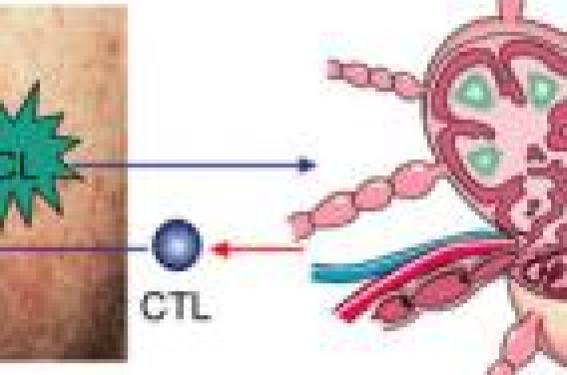
Comme la plupart des cancers, le mélanome est le résultat d'un déséquilibre entre la prolifération de cellules tumorales et la réponse immunologique de l'hôte contre les cellules de mélanome. Ceci est d'autant plus paradoxal pour le mélanome, qu'il s'agit d'une des tumeurs humaines les plus immunogéniques. Les cellules de mélanome sont en effet anormales et synthétisent des protéines tumorales reconnues comme étrangères par le système immunitaire(1). Le mélanome, une tumeur immunogène En 1992, le groupe de T. Boon de l'Institut Ludwig à Bruxelles a identifié les gènes MAGE codant les protéines tumorales reconnues par les lymphocytes T cytotoxiques (CTL) d'un patient (figure 1). Les auteurs ont cultivé des cellules issues de mélanome en présence des lymphocytes sanguins du même sujet. Au cours de cette co-culture, les lymphocytes reconnaissant les antigènes tumoraux, prolifèrent et se différencient en CTL spécifiques qui vont être sélectionnés et caractérisés. Ces travaux ont permis d'identifier les antigènes tumoraux qui sont présentés à la surface des cellules tumorales sous forme de peptides associés aux antigènes d'histocompatibilité de classe I. Plusieurs catégories d'antigènes peuvent être distinguées. Figure 1. Immunogénicité du mélanome. CL : cellule de Langerhans ; CTL : lymphocyte T cytotoxique. - Les antigènes spécifiques de cancers Ils peuvent être le produit de gènes normalement présent dans le génome, mais ne s'expriment qu'exceptionnellement dans les cellules adultes normales. C'est le cas de la famille des gènes MAGE, qui de façon exceptionnelle s'expriment aussi dans les testicules et le placenta, et des gangliosides. On peut également citer des antigènes (la bêtacaténine, par exemple) induits par la mutation de gènes normalement présents dans les cellules. Ils sont partagés par plusieurs types de tumeurs. - Les antigènes associés au mélanome Ce sont les produits de gènes de différenciation exprimés de façon limitée dans les tissus sains mais surexprimés ou amplifiés dans les tumeurs. Il s'agit, par exemple, de protéines spécifiques des mélanocytes comme la tyrosinase, ou la protéine melan-A/MART1. Le caractère immunogène du mélanome est responsable d'une réponse humorale (production d'anticorps) et/ou d'une réponse cellulaire (production de lymphocytes T cytotoxiques) dirigées contre des antigènes associés au mélanome. Des lymphocytes cytotoxiques spécifiques de ces antigènes ont pu être mis en évidence chez les patients porteurs de mélanome, en particulier au sein des populations de lymphocytes infiltrant les tumeurs (TIL). Les peptides tumoraux se trouvent à la surface des mélanocytes tumoraux étroitement associés aux molécules d'histocompatibilité de classe I. Le complexe peptide tumoral-molécules de classe I est spécifiquement reconnu par les CTL CD8+ du patient. La réponse immunitaire antitumorale Les CTL CD8+ sont dits " lymphocytes effecteurs " car ils vont détruire la cellule du mélanome. Ils sont issus de précurseurs CD8+ naïfs suite à une phase d'immunisation antitumorale qui nécessite la présentation des peptides tumoraux par des cellules dendritiques (cellules de Langerhans) aux lymphocytes T précurseurs. Cette phase d'immunisation se déroule dans les ganglions lymphatiques drainant le territoire cutané du mélanome. Les cellules de mélanome se développent dans l'épiderme et les cellules dendritiques voisines (cellules de Langerhans) vont capter les peptides tumoraux, puis migrer vers les ganglions où la présentation aux lymphocytes va s'effectuer. Pour induire une réponse immunitaire spécifique et optimale, la présentation des peptides tumoraux nécessite la collaboration et la reconnaissance de molécules d'histocompatibilité de classe I et de molécules de co-stimulation (figure 2). L'absence de ces signaux peut induire une réponse immunitaire de tolérance tumorale. Figure 2. Immunité antitumorale. AC : anticorps ; Cplt : complément ; Cellule K ADCC : cellule tueuse à cytotoxicité cellulaire médiée par les anticorps ; NK : cellule natural killer ; CTL : lymphocyte T cytotoxique ; Mc : mélanocyte tumoral. À côté des CTL CD8+, d'autres mécanismes de destruction des cellules tumorales sont possibles. Ils impliquent la cytolyse cellulaire médiée par les anticorps et le complément, la production de cellules Natural Killer (NK) et de cellules tueuses. À la différence de l'immunité antitumorale médiée par les CTL, ces mécanismes sont encore trop peu connus et peu maîtrisés pour avoir des implications thérapeutiques. Les mécanismes d'échappement tumoral Malgré le développement d'une immunité antitumorale quasi constante chez les patients, les cellules tumorales de mélanome sont le plus souvent capables de proliférer et de disséminer dans l'organisme. Plusieurs mécanismes d'échappement tumoral ont été décrits (figure 3). La tumeur échapperait à la réponse cytotoxique spécifique des CTL par modification permanente des peptides tumoraux immunogènes suite à des mutations successives de la cellule tumorale. L'expression des molécules d'histocompatibilité de classe I ou les molécules de co-stimulation, nécessaires au développement d'une réponse antitumorale efficace, serait altérée par des mutations successives des cellules tumorales. La cellule tumorale de mélanome est capable de produire et de libérer des cytokines immunosuppressives (TGFb et IL10). Enfin les cellules tumorales peuvent aussi être capables de détruire les CTL via l'expression de la molécule Fas-L. Figure 3. Échappement tumoral. Mc : mélanocyte tumoral ; CTL CD8+ : lymphocyte T cytotoxique effecteur ;TCR : récepteur lymphocytaire. Le mélanome échapperait à la réponse cytotoxique spécifique des CTL par modification permanente des peptides tumoraux immunogènes. L'ensemble de nos connaissances sur la réponse immunitaire antitumorale et les mécanismes d'échappement tumoral a entraîné le développement de nombreuses stratégies d'immunothérapie. On distingue les immunothérapies non spécifiques et les immunothérapies spécifiques. Les immunothérapies non spécifiques du mélanome Elles font appel à une stimulation non spécifique des CTL et concernent actuellement l'interféron alpha (IFNalphalpha). Interféron alpha Les effets antitumoraux de l'IFNalphalpha passent par une activité antiproliférative directe et par une activité immunologique (expression des molécules d'histocompatibilité de classe I par les mélanocytes tumoraux, activation des CTL et des cellules NK). De plus, l'IFNalphalpha possède une activité inhibitrice sur l'environnement tumoral en inhibant l'angiogenèse nécessaire au développement du mélanome. - Indications, schémas thérapeutiques et résultats Les indications de l'IFNalphalpha possédant l'AMM dans le mélanome sont le traitement adjuvant des mélanomes de stade II (> 1,5 mm) et III (mélanome avec métastase ganglionnaire après curage). Ces deux indications correspondent à deux protocoles thérapeutiques différents. - stade II : IFNalphalpha (Roféron®) à faibles doses(2), 3 MU, voie sous-cutanée, 3 fois par semaine, pendant 18 mois. Résultats : différence significative sur la survie sans rechute mais pas de différence significative sur la survie globale (2 études)(2). - stade III : IFNalpha (Introna®) à fortes doses(3) : o phase d'induction : 20 MU/m2 de surface corporelle, IV quotidienne, 5 jours par semaine, pendant 4 semaines. o phase d'entretien : 10 MU/m2 de surface corporelle, en sous-cutané, 3 fois par semaine, pendant 11 mois. Résultats : différence significative sur la survie sans rechute et sur la survie globale (1 seule étude à confirmer). - Effets secondaires Ils sont fréquents et dépendants de la dose, mais il existe aussi une susceptibilité individuelle non prévisible. Il s'agit essentiellement d'un syndrome grippal avec fièvre, céphalées, nausées, diarrhées, arthralgies et myalgies après les premières injections. Ces effets peuvent être responsables d'une altération de l'état général se manifestant par une anorexie, un amaigrissement, une asthénie et un syndrome dépressif, parfois majeur, en particulier chez les hommes. Des troubles de l'odorat et du goût ont été signalés de même que des troubles cardiaques (troubles du rythme, insuffisance cardiaque, angor), respiratoires (toux, dyspnée) des syndromes auto-immuns (thyroïdite, lupus, vascularite, etc.) ou des troubles oculaires. Sur le plan cutané, l'IFNalpha induit une sécheresse, parfois une chute de cheveux transitoire, des acrosyndromes et peut aggraver un psoriasis. Des réactions locales aux sites d'injections sont parfois possibles (eczéma, ulcération), mais sont évitées par le changement des sites d'injections. Certaines réactions systémiques à type d'eczéma ont été également décrites. Ils n'induisent pas de stérilité. Sur le plan biologique, l'IFNalpha induit essentiellement une neutropénie, une thrombopénie, une cytolyse hépatique, et parfois des hyperlipidémies. L'interféron alpha a l'AMM dans le traitement des mélanomes de stades II et III. - Contre-indications absolues : - Affections cardiaques sévères (arythmie, infarctus récent, insuffisance cardiaque), - Insuffisance hépatique, - Insuffisance rénale chronique sévère, - Antécédents psychiatriques, - Antécédents neurologiques, - Maladie auto-immune, - Affection thyroïdienne non contrôlée, - Transplantation d'organe. - Précautions avant mise en route du traitement La grossesse et l'allaitement sont contre-indiqués. Il est indispensable d'informer et prévenir les patients des effets psychologiques ou psychiatriques éventuels. Réaliser un hémogramme, un bilan hépatique et lipidique, la recherche d'anticorps antithyroïdien et antinucléaire et un ECG. Un contrôle ophtalmologique est conseillé en cas d'anomalie oculaire rapportée par le patient. - Prévention des effets secondaires : - Un soutien psychologique ou psychiatrique et/ou un par antidépresseur (paroxétine) doivent être proposés au patient. - Le paracétamol (Perfalgan® 1 g, IV) et/ou les corticoïdes (prednisone ou prednisolone 0,5 mg/ kg/j per os) diminuent les effets secondaires généraux. Problèmes posés La toxicité des fortes doses d'IFNalpha, la durée du traitement fixée arbitrairement à 12 ou 18 mois et le petit nombre d'études d'efficacité mettent en question le rapport risque-bénéfice du traitement adjuvant par IFNalpha dans le mélanome. D'où l'intérêt d'évaluer les effets d'un traitement mieux toléré (faibles doses) et poursuivi plus longtemps (étude EADO en cours, sur 36 mois). GM-CSF Le GM-CSF (Leucomax®) est un facteur de croissance hématopoïétique qui permet le recrutement et l'activation des cellules dendritiques et des macrophages. Il augmenterait ainsi la capacité de reconnaissance et de destruction des cellules tumorales. Différents essais ont montré son intérêt sur la survie à 2 ans ainsi que sa bonne tolérance chez des patients de stades II, III ou IV. Le protocole thérapeutique consistait en des injections sous-cutanées quotidiennes pendant 14 jours, suivies d'un repos thérapeutique de 14 jours puis reprise du traitement. Celui-ci semble donc prometteur soit en monothérapie, soit en combinaison avec une immunothérapie spécifique(4,5). Imiquimod L'imiquimod (Aldara®) est une molécule immunostimulante qui possède une activité antivirale et antitumorale. Après fixation sur un récepteur présent à la surface des kératinocytes, des cellules mononucléées sanguines et des mélanocytes, l'imiquimod induit la production de cytokines (IFNalpha et TNFa en particulier) intervenant dans la réponse immunitaire antitumorale et antivirale. Plusieurs études ont montré son efficacité pour le traitement local des mélanomes de Dubreuilh et des métastases cutanées de mélanome(6, 7). Les immunothérapies spécifiques du mélanome Différentes stratégies sont actuellement en cours d'évaluation dans des essais. Leur principal intérêt est leur absence de toxicité systémique. Stimulation d'une réaction humorale spécifique contre les gangliosides Les gangliosides sont des carbohydrates (glycolipides) surexprimés à la surface des cellules tumorales de différentes tumeurs, dont les mélanomes (95 %). Ils sont capables d'induire une réaction immunitaire humorale facilement évaluable par le dosage sérique des anticorps IgM et IgG produits, mais aussi une cytolyse cellulaire médiée par les anticorps et le complément. Cinq à 10 % des sujets porteurs de mélanome possèdent spontanément des IgM anti-GM2 leur conférant un meilleur pronostic. Bien que les gangliosides GM2 se retrouvent également dans les cellules normales, aucune auto-immunité ni aucune immunotolérance n'ont été détectées ou déclenchées après induction d'une réponse humorale. La préparation vaccinale associe les gangliosides GM2 synthétisés, une protéine transporteuse (KLH), et un adjuvant immunitaire (Stimulon®). Elle a été testée et retenue en raison de sa capacité fiable et reproductible (environ 40 % des patients vaccinés) à induire une réponse immunitaire humorale élevée et durable. Dans une étude randomisée réalisée dans le mélanome de stade III, les patients vaccinés ayant développé une réponse humorale anti-GM2 présentaient une survie sans récidive et une survie globale plus élevée que les patients vaccinés n'ayant pas développé d'anticorps anti-GM2(8). Les seuls effets secondaires rapportés consistent en des réactions d'irritation au sites d'injections sous-cutanées. Aucun effet secondaire systémique n'a été rapporté. Actuellement, cette stratégie vaccinale est en cours d'évaluation dans le cadre d'un essai européen coordonné par l'EORTC* (GM2, 18961)(9). Elle est évaluée en tant que traitement adjuvant des mélanomes de stade II (> 1,5 mm). L'étude comporte deux groupes de patients (observation vs vaccin) sur une durée de 3 ans. D'autres vaccins induisant une réponse humorale antitumorale sont également développés(10). La stratégie vaccinale à base de GM2 est en cours d'évaluation dans le cadre d'un essai européen coordonné par l'EORTC. Stimulation d'une réponse immunitaire cellulaire cytotoxique - La thérapie cellulaire L'immunothérapie passive ou adoptive (figure 4). Cette stratégie est développée par l'équipe du Pr Brigitte Dréno à Nantes(11,12). Les lymphocytes infiltrants la tumeur (TIL) sont extraits d'une métastase de mélanome ou du mélanome primaire. Leur expansion in vitro permet d'en obtenir plusieurs milliards qui peuvent être ensuite réinjectés au malade de façon autologue. Les études cliniques ont permis d'obtenir des taux de réponse de l'ordre de 35 %, mais de courte durée. Leur place comme traitement adjuvant après curage ganglionnaire est en cours d'étude. Figure 4. Schéma de l'immunothérapie passive et adoptive. La réponse à l'immunothérapie passive par réinjection de lymphocytes infiltrant la tumeur (TIL) est encore actuellement de courte durée. Les lysats tumoraux autologues ou allogéniques irradiés. Cette stratégie vaccinale consiste à injecter des lysats de cellules mélaniques irradiées provenant soit d'une métastase du patient (système autologue), soit d'une lignée allogénique. La spécificité antigénique n'est plus nécessaire(13). Les cellules dendritiques sont capables de présenter très efficacement les antigènes tumoraux aux lymphocytes T. Plusieurs essais prometteurs ont montré des réponses immunologiques antitumorales après injection de ces cellules préalablement sensibilisées (pulsées) avec des peptides de mélanome(14,15). - La vaccination Différents peptides tumoraux de mélanome (MAGE, tyrosinase, NA17.A2, HSP) ont été identifiés comme étant capables d'induire la production de CTL spécifique dans un contexte de présentation antigénique restreinte par l'antigène d'histocompatibilité HLA (HLA-A1 pour MAGE 1 et MAGE 3, HLA-A2 qui est présent chez environ 50 % de la population caucasienne pour MelanA/tyrosinase et NA17). Ces vaccins ne peuvent être injectés qu'à des malades dont les métastases expriment ces peptides antigéniques. Des réponses cliniques ont été rapportées sur des cibles sous-cutanées essentiellement(16). - La thérapie génique ex vivo Cette stratégie consiste à transfecter des cellules tumorales de mélanome pour leur faire exprimer des antigènes augmentant leur reconnaissance par les CTL. Il s'agit donc de l'injection de cellules tumorales génétiquement modifiées (HLA-I, molécules de co-stimulation, cytokines activant le système immunitaire : TNFa, GM-CSF). Cette stratégie est limitée par la difficultés à obtenir un nombre important de cellules génétiquement modifiées et à maintenir leur transfection(17). - La thérapie génique in vivo Elle consiste à injecter directement dans la métastase un gène (ADN nu) codant des protéines qui vont faciliter la reconnaissance des cellules tumorales par les CTL(18). Conclusion Au total, depuis la découverte des premiers antigènes de mélanome, plusieurs dizaines d'essais cliniques sont en cours. La plupart des réponses thérapeutiques sont observées dans les stades précoces de mélanome et sur des cibles cutanées, sous-cutanées, ou ganglionnaires. Les différentes stratégies d'immunothérapies spécifiques doivent être cependant optimisées en termes de préparation et doivent tenir compte du statut immunitaire du malade qui diminue avec la progression de la maladie.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :