Publié le 20 fév 2011Lecture 11 min
Le ganglion sentinelle dans le mélanome
C. BIVER-DALLE, Service de dermatologie, CHU de Besançon
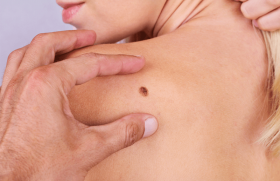
La méthode de détection opératoire du ganglion sentinelle a fait l’objet d’un consensus pour la prise en charge du mélanome d’épaisseur intermédiaire (0,75-4 mm). Elle nécessite un temps de repérage scintigraphique par gamma caméra et un temps opératoire. L’examen anatomopathologique avec immunomarquarge du ganglion prélevé clôt la procédure. Le statut du ganglion sentinelle a une valeur pronostique et permet de justifier les thérapies adjuvantes.
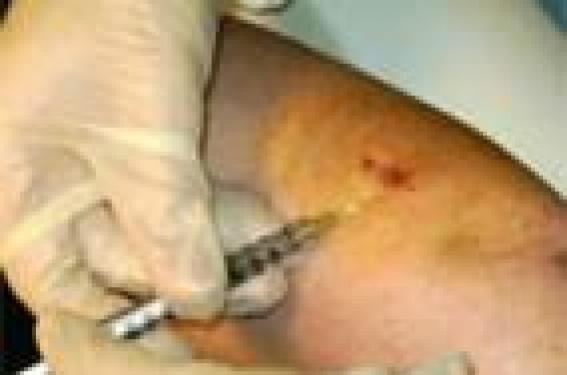
Historique Le ganglion sentinelle (GS) est défini comme le premier ganglion de drainage d’une zone de tissu au sein de laquelle se trouve une tumeur. L’équipe allemande de K. Winkel fut la première à utiliser la technique lymphoscintigraphique pour localiser le bassin de drainage lymphatique du mélanome en 1972 (1). C’est R.M. Cabanas, dans le cancer de la verge, qui démontra dès 1977 qu’un ganglion qu’il appela « sentinelle », dont la situation anatomique était bien définie, était le premier susceptible (parfois le seul) d’être envahi par la tumeur, et que l’état histologique de celui-ci permettait de sélectionner les patients devant bénéficier d’un curage ganglionnaire (2). Ce concept fut repris par D.L. Morton dans le cadre du traitement des mélanomes de stade I d’épaisseur intermédiaire (entre 0,75 mm et 4 mm) pour lesquels se pose la question du bénéfice thérapeutique d’un curage ganglionnaire, en balance avec sa morbidité (3). Des améliorations techniques ont progressivement renforcé la rentabilité diagnostique de cette méthode qui est devenue un standard international lors du consensus d’Augsburg en 2000, et incorporée dans la prise en charge initiale du mélanome d’épaisseur intermédiaire. Première étape : la lymphoscintigraphie préopératoire C’est la visualisation scintigraphique du drainage lymphatique après injection autour du mélanome d’un traceur lymphotrope marqué avec un émetteur gamma. Elle comporte une étape dynamique au temps précoce puis deux clichés, l’un au temps précoce, l’autre au temps tardif pour cartographier les ganglions (4). Le radiocolloïde idéal pour identifier le GS est celui dont la taille permet son entrée directe dans les capillaires lymphatiques, c’està- dire idéalement de taille comprise entre 5 et 50 nm (5). Les radiocolloïdes actuellement utilisés sont soit le sulfure de rhénium colloïdal marqué au 99mTc (Nanocis®), soit des nanocolloïdes d’albumine humaine marquée au 99mTc (Nanocoll®). Figure 1. Injection du radiocolloïde autour de la cicatrice d’exérèse initiale d’un mélanome de bras droit. Après injection, le passage des radiocolloïdes est immédiat et passif au travers des collecteurs lymphatiques puis, via le système lymphatique, le transport vers les ganglions lymphatiques est rapide. Ces radiocolloïdes sont ensuite phagocytés dans les sinus périphériques des ganglions par les cellules du système histiomonocytaire. L’activité des ganglions lymphatiques à la première heure varie de 3 à 5 % de l’activité injectée. L’activité administrée est variable d’une équipe à l’autre, comprise entre 10 et 100 MBq. Le volume injecté doit être faible pour ne pas perturber le drainage physiologique, habituellement de 0,1 à 0,3 ml par injection. Dans le cadre du mélanome, le mode d’injection préférentiel est l’injection intradermique (créant une papule lors de l’injection) péritumorale (4 à 6 injections circonscrivant la zone tumorale) si le mélanome est en place, ou autour de la biopsie-exérèse initiale (figure 1) en évitant l’injection dans la cicatrice et toujours avant reprise chirurgicale étendue (4). L’acquisition des images se fait grâce à une gamma caméra (figure 2). Dès l’injection du traceur, l’acquisition des images se fait en mode dynamique pour visualiser le flux lymphatique jusqu’au premier relais ganglionnaire, où un cliché statique « précoce » est réalisé. Cette première étape prend en général 10 à 20 minutes. Un second cliché statique, dit tardif, est réalisé 2 h à 2 h 30 plus tard, temps nécessaire au radiocolloïde pour atteindre toutes les aires ganglionnaires potentiellement drainantes (figure 3). Les régions explorées du corps vont dépendre de la localisation initiale du mélanome. Schématiquement, vont être inclus : – pour un mélanome du thorax : les deux creux axillaires, le cou, mais aussi l’abdomen et le pelvis ; – pour un mélanome de l’abdomen : le creux axillaire et inguinal homolatéral à la lésion, voire les quatre régions si la tumeur est très médiane ; – pour un mélanome du dos : les deux creux axillaires et inguinaux, voire la région susclaviculaire et péricervicale ; – pour un mélanome du membre supérieur : le coude puis le creux axillaire ; – pour un mélanome du membre inférieur : la jambe et le creux poplité (si lésion distale) puis l’aine avec la racine de la cuisse et le triangle de Scarpa (4). Le ganglion lymphatique fixe le radiocolloïde par un mécanisme beaucoup plus complexe qu’une simple filtration mécanique (5). En effet, l’opsonisation du radiocolloïde (mécanisme par lequel le radiocolloïde est reconnu comme molécule étrangère) est nécessaire dans un premier temps. Elle a lieu soit directement dans le liquide lymphatique, soit au sein du ganglion lymphatique. La matrice de fibrilles de réticuline située dans le sinus périphérique des ganglions permet de ralentir le flux des particules (telles que le radiocolloïde) pour permettre leur phagocytose par les macrophages et le tissu histiocytaire. La majeure partie du radiocolloïde va être retenue dans le GS par ce mécanisme. Le pourcentage de traceur qui passera vers un 2e ou un 3e ganglion dépend de la taille de la particule et de la vitesse du flux lymphatique dans les vaisseaux collecteurs. Plus le flux est rapide, plus l’incidence de passage du radiocolloïde vers un 2e ou 3e ganglion sera importante, supposant donc que le mécanisme de phagocytose qui retient le radiocolloïde dans le ganglion peut être dépassé si trop de particules atteignent le ganglion en un trop court laps de temps. L’objectif du traitement des images va être d’obtenir un contraste optimal montrant sur la même scintigraphie le site d’injection et les fixations ganglionnaires. Figure 2. Système d’acquisition des images : gamma caméra et collimateur. Le ou les ganglions retenus comme sentinelles avec leur topographie sont alors clairement décrits, en signalant s’il existe une seule ou plusieurs voies de drainage amenant vers le GS et en différenciant les ganglions positifs en amont du GS dits « non sentinelles ou secondaires » des GS multiples (ganglions de même activité situés à l’extrémité de voies de drainage différentes). Les artéfacts et sources d’erreurs sont liés à la contamination cutanée, à l’existence de ganglions secondaires et aux métastases ganglionnaires massives (risque d’absence de concentration du radiocolloïde à cause d’une architecture des vaisseaux et des sinus lymphatiques détruite par les métastases). Une fois la scintigraphie réalisée, le repérage cutané en regard du GS est réalisé (figure 4) afin de guider l’incision chirurgicale. Les projections sont obtenues par interposition entre le point chaud (= le GS) et le récepteur d’une source de cobalt 57. Le déroulement du marquage cutané est suivi visuellement sur l’écran de contrôle de la gamma caméra. Le délai entre l’injection du radiocolloïde et la chirurgie fait débat. À l’heure actuelle, un délai de 18 à 24 h, avec la réalisation préopératoire d’un marquage au bleu, permettrait d’identifier tous les GS (6,7) en limitant l’exposition aux radiations de l’équipe chirurgicale. Figure 3. Exemple de cliché de lymphoscintigraphie : recherche du ganglion sentinelle d’un mélanome du bras droit : a) cliché précoce ; b) cliché tardif. Deuxième étape : le temps opératoire Une injection de bleu patenté, colorant lymphotrope labile, est généralement réalisée au minimum 10 minutes avant la chirurgie, en périphérie du mélanome ou de la cicatrice d’exérèse (figure 5). Figure 4. Repérage cutané en regard du ganglion sentinelle. La technique du bleu dans le mélanome permet un deuxième marquage du GS après la lymphoscintigraphie et augmente de ce fait le taux d’individualisation du GS(4). Une sonde de détection gamma est alors introduite à travers l’incision réalisée à proximité du repérage cutané (figure 6). De par son caractère directionnel, cette sonde permet de guider le chirurgien dans la recherche du GS. Les critères de définition du GS lors de la détection isotopique opératoire ne sont pas consensuels. Pour certains, il s’agit du ganglion ayant la plus haute activité, les autres sont dits « non sentinelles » si leur activité est inférieure à 50 % de celle du GS. Pour d’autres, la définition repose sur un ratio (méthode plus reproductible), soit in vivo : rapport de 2/1 ou de 3/1 par rapport au bruit de fond ; soit ex vivo : rapport de 10/1 par rapport aux ganglions « non sentinelles ». L’activité résiduelle dans l’aire ganglionnaire doit être vérifiée après exérèse du ou des GS. Une activité résiduelle importante (> 10 % de l’activité du GS in vivo ou > 150 % du bruit de fond) doit faire rechercher un éventuel GS additionnel laissé en place(4). Une fois repéré, le ganglion est envoyé au laboratoire d’anatomopathologie à l’état frais. Troisième étape : l’examen anatomopathologique L’examen anatomopathologique est un examen clé de la technique du GS. En effet, la sensibilité de la méthode est directement liée à l’analyse histologique du ganglion. Selon le nombre de coupes et le type de colorations, différents volumes de métastases peuvent être individualisés(4). Figure 5. Injection de bleu patenté en préopératoire autour d’un mélanome. La micrométastase ganglionnaire de mélanome est un envahissement histologique partiel d’un ganglion régional non palpable cliniquement, enlevé au cours de la technique du GS ou d’un curage ganglionnaire, par un amas de cellules néoplasiques mesurant moins de 2 mm sous la forme d’emboles sous-capsulaires et/ou de microfoyers corticaux. Afin d’augmenter la sensibilité de la lecture histologique, après fixation du ganglion dans le formol, inclusion en bloc de paraffine et coloration par l’HES (figure 7), la recherche des cellules mélanocytaires par immunohistochimie peut être réalisée. Les anticorps (Ac) dirigés contre la cellule mélanocytaire actuellement utilisés sont l’Ac anti-protéine S100 (PS 100), l’Ac anti-Melan-A (MART 1), l’Ac anti-HMB45 (figure 8). Il n’existe pas à l’heure actuelle d’anticorps capable de détecter les cellules mélanocytaires avec une spécificité de 100 %. Aucun anticorps ne permet non plus de détecter la transformation maligne de ces cellules mélanocytaires, mais l’expression combinée de plusieurs marqueurs permet d’obtenir d’excellents niveaux de sensibilité ou de spécificité. Figure 6. Détection opératoire du ganglion sentinelle : a) sonde opératoire de détection gamma ; b) introduction d’une sonde de détection gamma à travers l’incision réalisée à proximité du repérage cutané ; c) différence de radioactivité entre le GS (en bas) et les autres ganglions ; d) extraction du GS, sous contrôle de sa radioactivité. Idéalement, le compte rendu histologique doit préciser : – l’identité du patient, la localisation anatomique du GS et le nombre de GS identifiés ; – le nom du chirurgien opérateur, s’il a utilisé une coloration au bleu, et la radioactivité du GS enlevé ; – la taille du ou des GS, le nombre de coupes réalisées. En cas de métastase, il doit préciser : – sa localisation : sous-capsulaire, combinée, du parenchyme : cortex, médullaire, multifocale, extensive ; – s’il y a extension extracapsulaire ; – le diamètre du plus gros dépôt métastatique ; – sa profondeur par rapport à la capsule (en mm) ; – le pourcentage de l’aire ganglionnaire occupée par la métastase ; – l’immunophénotypage tumoral : positivité pour les protéines S100, Melan-A et HMB 45. Conclusion À l’apparente simplicité du principe et du geste technique d’exérèse du ganglion sentinelle dans le mélanome, il faut opposer des problèmes méthodologiques, conceptuels et pratiques à l’origine de faux négatifs et d’une sensibilité variable. La collaboration étroite entre les trois spécialités directement impliquées (médecine nucléaire, chirurgie et anatomopathologie) reste le garant de sa validité. Le statut du GS reste un outil pronostique valable pour le mélanome qui continue de faire ses preuves pour identifier les patients justifiant de thérapies adjuvantes. Cette technique a par ailleurs permis de redécouvrir la complexité de l’anatomie lymphatique et d’améliorer les connaissances sur le comportement métastatique du mélanome. Figure 7. Aspect histologique de ganglion sentinelle métastatique marqué par HES. Figure 8. Aspect histologique de ganglion sentinelle métastatique après immunomarquage : a) Ac anti-PS 100 ; b) Ac anti-HMB 45 ; c) Ac anti-Melan A.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :