Article du mois
Publié le 11 fév 2022Lecture 3 min
Efficacité du bimékizumab dans la maladie de Verneuil : résultats prometteurs d’un essai de phase 2
François CHASSET, Service de dermatologie et d’allergologie, hôpital Tenon, Paris

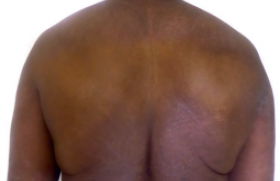
La maladie de Verneuil ou hidradénite suppurée (HS) est une maladie inflammatoire chronique fréquente puisqu’elle touche jusqu’à 1% de la population selon les études, avec un âge de 22 ans en moyenne au début de la maladie. Elle se caractérise, dans la forme classique, par des nodules inflammatoires et des abcès profonds, douloureux, touchant particulièrement les plis axillaires, inguinaux et les fesses. Les abcès nécessitent souvent une prise en charge chirurgicale et sont très douloureux. Cette pathologie est associée à un retentissement majeur sur la qualité de vie, à des troubles de l’humeur et à une anxiété majeure.
Le traitement de l’HS est mal codifié. Les antibiotiques sont utilisés pour les poussées et en prévention des récidives, en particulier la doxycycline, l’association rifampicine + Dalacine,ou le cotrimoxazole avec une efficacité limitée. L’adalimumab a montré son efficacité dans 2 essais contrôlés randomisés de phase 3 mais a très longtemps été non remboursé. Les cytokines IL-17, en particulier IL-17A et IL-17F, ont un rôle important dans la physiopathologie de l’HS.
Dans cette étude, les auteurs rapportent l’efficacité du bimekizumab, un anti IL-17A et IL-17F dans un essai contrôlé, randomisé de phase 2. Il s’agissait d’un essai international, contrôlé, randomisé de phase 2, stratifié sur la sévérité de la maladie (par les stades Hurley) incluant des patients avec une HS modérée à sévère, entre 18 et 70 ans, randomisés 2:1:1 pour recevoir du bimekizumab 320 mg toutes les 2 semaines après une dose de charge de 640 mg ou un placebo toutes les 2 semaines ou de l’adalimumab 40 mg toutes les 2 semaines après une dose de charge de 160 mg puis de 80 mg. Le critère de jugement principal était la proportion de patients atteignant une amélioration de plus de 50% du score Hidradenitis Suppurativa Clinical Response (HiSCR 50) comptabilisant le nombre de nodules ou d’abcès inflammatoires à la semaine 12. Les scores HiSCR 75 et 90 étaient également évalués ainsi que la qualité de vie. La tolérance était évaluée sur 20 semaines supplémentaires, soit une durée de 32 semaines pour l’étude.
Au total, 46 patients ont été randomisés dans le groupe bimekizumab, 22 dans les groupes placebo et adalimumab. HiSCR 50 était atteint significativement plus fréquemment dans le groupe bimekizumab 57,3 % versus 26 % dans le groupe placebo (probabilité de supériorité de 99,8% en analyse bayésienne). La fréquence d’obtention des scores HiSCR75 et 90 à la semaine 12 était de 46 % et 32 % pour le bimekizumab vs 10 % et 0 % respectivement pour le placebo. Le score HiSCR 50 était similaire entre le bimekizumab et l’adalimumab 57,3 % vs 60 %, et les scores HiSCR75 et 90 tendaient à être supérieurs pour le bimekizumab 46 % vs 35 % et 32 % vs 15 % sans différence significative. La tolérance était acceptable avec un taux d’effet indésirable sévère de 4 % dans le groupe bimekizumab, 4 % dans le groupe placebo et 2 % dans le groupe adalimumab. En analysant les effets indésirables, on notait une prévalence peut- être plus importante pour les troubles digestifs : 15 % pour le bimekizumab vs 3 % et 7 % dans les groupes placebo et adalimumab respectivement sans survenue de maladie inflammatoire chronique de l’intestin, davantage de réaction au point d’injection 20 % vs 3 % et 11% respectivement, et davantage d’infection en particulier des candidose 4 % vs 0% et 1 % respectivement. Il n’a pas été noté d’effet indésirable inattendu par rapport au profil de tolérance classique des anti-IL17.
Au total, cet essai montre l’intérêt d’une stratégie de blocage de la voie des IL-17A et IL-17F dans l’HS avec une supériorité vs placebo. En revanche la place ou l’éventuelle supériorité par rapport aux anti-TNF alpha sera à évaluer dans un essai de phase 3.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :