Publié le 01 juin 2021Lecture 13 min
Porphyrie cutanée tardive
Camille FRANCÈS, Paris
La porphyrie cutanée tardive est la plus fréquente des porphyries vues en dermatologie, le plus souvent acquise en rapport avec une affection chronique du foie, plus rarement génétique. La fréquence des différents facteurs déclenchants a été modifiée depuis le traitement efficace des hépatites C.
La porphyrie cutanée tardive est une affection liée à un déficit intrahépatique d’uroporphyrinogène décarboxylase (UROD), le cinquième enzyme dans la synthèse de l’hème (figure 1). Il s’agit d’une maladie chronique avec des poussées et des rémissions d’expression essentiellement cutanée.
Figure 1. Schéma de la synthèse de l’hème avec les enzymes qui interviennent et les maladies correspondantes à leur déficit.
ÉPIDÉMIOLOGIE- GÉNÉTIQUE
La porphyrie cutanée tardive (PCT) est la plus fréquente des porphyries, représentant 80 à 90 % de toutes les porphyries(1,2), en rapport avec un déficit en UROD. Sa prévalence(3) est variable selon les pays de 1/5000 à 1/70 000 (tableau 1). Le gène de l’UROD de 3,6 kb est situé sur le chromosome 1P34 (bras court). L’UROD est présente dans tous les tissus. Le déficit ne s’exprime cliniquement que si l’activité enzymatique est inférieure à 20 % de la norme dans le foie. Il en existe plusieurs formes. Dans le type I, le plus fréquent (75-80 % des cas), dit sporadique, le déficit en UROD n’est mis en évidence que dans les cellules hépatocytaires. Il est qualitatif, net au cours des poussées, pouvant se normaliser lors des périodes de rémission ou sous l’effet d’un traitement. Il se traduit par une réduction de l’activité catalytique en UROD contrastant avec des dosages normaux, voire élevés d’UROD par des méthodes radio-immunologiques. Il existe volontiers une atteinte hépatique concomitante. Le rôle des facteurs inducteurs est déterminant. Il s’agit d’une forme d’apparition relativement tardive au-delà de 40 ans avec une prédominance masculine.
Le type II (20 à 25 % des cas) correspond à la forme familiale de PCT dans laquelle existe un déficit hétérozygote en UROD, transmis de façon autosomale dominante avec une faible pénétrance. Probablement moins de 10 % des porteurs du déficit ont des manifestations cliniques. L’activité de l’UROD est réduite de moitié dans toutes les cellules de l’organisme, notamment dans les globules rouges et les cellules hépatiques. Un ou plusieurs autres facteurs déclenchants sont indispensables, comme dans le type I, à l’expression clinique de la maladie correspondant à une activité UROD dans les hépatocytes à moins de 20 %. Le déficit homozygote en UROD est exceptionnel se traduisant par une porphyrie hépato-érythropoïétique proche de la porphyrie érythropoïétique congénitale ou maladie de Günther. Plus de 100 mutations différentes ont été identifiées sur le gène de l’UROD dans ces formes héréditaires(2).
La troisième forme, rare (< 5 % des cas), est aussi familiale conduisant à un déficit de l’UROD hépatique sans déficit dans les globules rouges. L’individualisation d’un type IV est controversée ; le type IV correspondrait à une forme toxique où l’inhibition de l’UROD dans le foie serait induite par un agent chimique exogène (hexachlorobenzène ou dioxine). Le tableau clinique y serait plus sévère avec une photosensibilité majeure pouvant persister plusieurs années après l’arrêt de l’intoxication, une hypertrichose intense et fréquente, des arthrites et une hypertrophie thyroïdienne.
ASPECTS CLINIQUES
Quel que soit le type de PCT, la symptomatologie clinique est similaire. Les manifestations dermatologiques prédominent nettement sur les zones exposées, témoignant de la photosensibilité des porphyrines accumulées dans le derme. Leur spectre maximal d’absorption de l’énergie lumineuse se situe entre 400 et 410 nm avec une bande secondaire dans la lumière visible entre 580 et 650 nm.
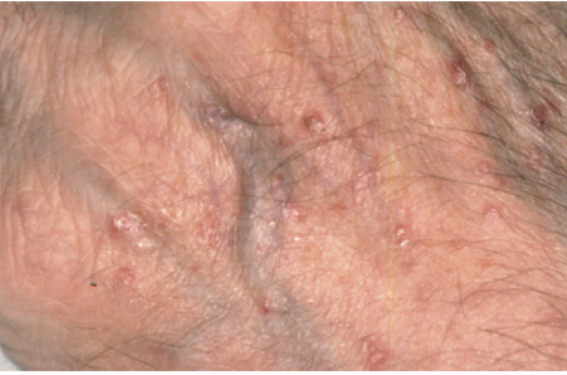
L’hyperfragilité cutanée est la principale manifestation cutanée à l’origine de bulles séreuses ou hémorragiques et d’érosions après des traumatismes minimes notamment sur le dos des mains ou le visage (figures 2 et 3). Des bulles peuvent également apparaître après exposition solaire sur les parties découvertes (figure 4). Généralement éphémères, elles laissent rapidement place à des érosions, des croûtes brunâtres avec formation secondaire de grains de milium (figure 5). Les muqueuses sont strictement normales.
Figure 2. Aspect excorié du dos de la main témoignant de la fragilité cutanée.
Figure 3. Aspect excorié du visage lié à la fragilité cutanée.
Figure 4. Bulle sur le dos de la main avec excoriation.
Figure 5. Grains de milium secondaires aux bulles cutanées sur une zone exposée.
Les autres manifestations cliniques sont inconstantes. Le prurit, prédominant sur les zones exposées, n’a pas de signification pronostique. L’hypertrichose temporo-malaire est d’intensité variable, le plus souvent modérée avec des touffes de longs poils noirs sur les pommettes et la zone latéro-orbitaire (figure 6), ailleurs plus diffuse (figure 7). Il peut exister un brunissement des cheveux. Des dyschromies sont fréquentes avec des nappes pigmentées uniformes ou hétérogènes « en éclaboussures » pouvant être associées à des taches achromiques (figure 8). Un aspect d’héliodermie est parfois constaté correspondant à un vieillissement prématuré de la peau photo-induit avec élastose, rides profondes et comédons (figure 9). Dans un tiers des cas environ apparaissent tardivement des lésions sclérodermiformes du visage, du cou, du décolleté, du tronc et du cuir chevelu avec alopécie (figures 10 et 11). Elles pourraient être secondaires à la stimulation de la synthèse du collagène par l’uroporphyrine I comme cela a été démontré in vitro sur cultures de fibroblastes indépendamment de toute irradiation solaire. Les dépôts calcaires dans ces plaques, source d’ulcérations atones, sont rares.
Figure 6. Hypertrichose malaire.
Figure 7. Hypertrichose diffuse du visage avec pigmentation.
Figure 8. Pigmentation du visage.
Figure 9. Élastose du front avec comédons.
Figure 10. Aspect sclérodermiforme du cuir chevelu avec alopécie secondaire.
Figure 11. Aspect sclérodermiforme diffus du tronc au cours d’une PCT.
FACTEURS INDUCTEURS DE PCT
La surcharge ferrique
La relation entre PCT et surcharge ferrique est connue depuis très longtemps. En effet, la large majorité (60-70 %) des PCT a une surcharge en fer. La diminution des réserves de fer améliore cliniquement et biologiquement les PCT alors que l’augmentation de ces réserves les aggrave. Des mutations ont été mises en évidence dans la zone régulatrice de quatre gènes intervenant dans l’homéostase du fer (céruloplasmine, cytochrome B réductase 1, l’hepcidine, peptide anti-microbien, membre A1 de la famille 40 des transporteurssolubles)(4).
L’association hémochromatose et PCT est connue comme le montre une métaanalyse de 2007 portant sur 66 000 sujets atteints d’hémochromatose et 226 000 contrôles(5). La présence de mutations C282Y/C282Y augmentait le risque de PCT avec un odd ratio de 48, la présence de mutations C282Y/H63D augmentait le risque de PCT avec un odd ratio de 8,1. En cas de mutation hétérozygote C282Y, l’odd ratio était à 3,6. La double mutation H63D/H63D était accompagnée d’un odd ratio à 3. La mutation hétérozygote H63D n’était pas associée à une augmentation de prévalence de la PCT.
Le fer augmente la production d’uroporphyrines par actions essentiellement à trois niveaux (figure 12) : (1) augmentation du stress oxydatif d’où l’oxydation de l’uroporphyrinogène et de l’heptacarboxylporphyrinogène en leur dérivé porphyrine ; (2) diminution de l’activité de l’UROD par synthèse d’un inhibiteur, probablement dérivé de l’hydroxyméthylbilane et/ou de l’uroporphyrinogène ; (3) stimulation de la synthèse de l’acide delta-aminolévulinique, précurseur de l’uroporphyrinogène(6). L’hydroxyméthylbilane est le précurseur tétrapyrolé de l’uroporphyrinogène. La formation d’un inhibiteur de l’UROD dans la cellule hépatique résulte d’un phénomène d’oxydation favorisée par le fer, l’activité du cytochrome P-4501A2, l’alcool, les œstrogènes. Dans deux modèles murins, l’inhibiteur a été identifié par spectroscopie de masse comme étant l’uroporphométhène, composé proche de l’uroporphyrinogène qui s’en distingue par la présence d’un pont carbone oxydé. L’effet inhibiteur serait plus marqué sur l’isomère III que sur le I.
La diminution de l’hepcidine augmente l’absorption du fer par le tube digestif.
Figure 12. Différents niveaux d’intervention du fer dans le métabolisme des porphyrines au niveau de l’hépatocyte.
Abréviations. Fe : fer ; ALA : acide delta aminolévulinique ; SO : stress oxydatif ; VHC : virus de l’hépatite C, FC : ferrochélatase, TD : tube digestif.
L’alcoolisme
Une intoxication alcoolique est présente chez 30 à 90 % des malades avec PCT, surtout dans les formes sporadiques. Or, l’alcool augmente l’absorption du fer, facilite le relargage du fer de ses protéines ligands, stimule la synthétase de l’acide delta aminolévulinique, inhibe l’UROD, favorise la production de radicaux libres.
Le virus de l’hépatite C (VHC)
Le VHC joue également un rôle très important dans l’apparition d’une PCT puisqu’il était présent chez 20 à 80 % des patients, en fonction de leur origine géographique. Dans la majorité des cas, il s’agit d’une infection active avec présence d’ARN viral et élévation des transaminases. Cependant, les mécanismes physiopathologiques de cette association restent encore mal expliqués, faisant possiblement intervenir une surcharge ferrique ou le cytochrome P450. Le traitement, aujourd’hui efficace des hépatites C, a permis de diminuer le rôle de ce facteur inducteur.
L’infection par le virus de l’immunodéficience humaine (VIH)
Le VIH a un rôle difficile à déterminer, car il y a très souvent une co-infection avec le VHC et la présence d’autres facteurs inducteurs (alcool, médicaments).
L’intoxication tabagique
Très fréquente au cours de la PCT sporadique (> 80 %), l’intoxication tabagique interviendrait par l’augmentation du stress oxydatif et l’induction des enzymes hépatiques du cytochrome P450. Il ne s’agit que de simples hypothèses, le tabac étant généralement associé à d’autres facteurs inducteurs.
Les médicaments
Parmi tous les médicaments inducteurs de poussées, les œstrogènes ont une place prépondérante notamment lors de traitements à fortes doses pour des cancers prostatiques ou un changement de sexe. Il faut également signaler le rôle inducteur majeur des contraceptifs oraux. Les œstrogènes sont connus chez le rat pour augmenter les stocks de fer. En revanche, la grossesse n’a pas systématiquement un rôle aggravant. Les autres médicaments dits « porphyrinogènes » sont plus rarement mis en cause : barbituriques, hydantoïne, sulfamides, rifamycine, griséofulvine, vitamine B12, méthotrexate, cyclophosphamide, busulfan, sinvastatine, pravastatine... La liste des médicaments, régulièrement actualisée à éviter en cas de porphyrie et selon le type de porphyrie, est disponible sur le site du Centre français des porphyries (www.porphyrie.net).
Les agents toxiques L’hexachlorobenzène, utilisé comme fungicide pour les cultures, a été à l’origine de véritables épidémies de PCT en Turquie dans les années 1950. Son rôle inhibiteur de l’UROD hépatocytaire a été démontré chez l’animal avec induction de PCT expérimentales. D’autres hydrocarbures chlorés comme la dioxine, puissant activateur de l’acide delta aminolévulinique synthétase, peuvent également induire des PCT. L’origine professionnelle de facteurs toxiques induisant des PCT est possible.
BILAN PARACLINIQUE
Il permet de confirmer la PCT, de préciser la nature et la cause de l’éventuelle hépatopathie associée et d’apprécier les éléments importants pouvant guider les choix thérapeutiques.
Le diagnostic de PCT repose sur l’augmentation urinaire des uroporphyrines (forme 8-carboxylée avec 60 % d’isomère I et 40 % d’isomère III, formes 7- et 6-carboxylée avec 90 % d’isomère III) et des coproporphyrines avec un rapport uroporphyrines/coproporphyrines > 3. La fluorescence rosée des urines examinées en lumière de Wood témoignant de la présence de porphyrines dans les urines est inconstante. Dans les selles, l’isocoproporphyrine dérivée des isomères III est majoritaire. Actuellement, le type isomérique de ces porphyrines n’est plus étudié en pratique courante, et leur simple présence en quantité très supérieure à la normale dans les urines et les selles permet d’affirmer le diagnostic de porphyrie. Les dosages hépatiques, s’ils étaient pratiqués, révéleraient une accumulation des uroporphyrines et des porphyrines 7-carboxylées. Les dosages sériques montrent une distribution des porphyrines voisine de celles des urines.
La biopsie cutanée n’est généralement faite que si le diagnostic n’avait pas été suspecté cliniquement. L’aspect histologique d’une bulle est évocateur de PCT du fait d’un décollement sous-épidermique (figure 13), de l’absence de cellule dans la zone décollée et d’un plancher festonné (figure 14). L’étude en immunofluorescence directe montre des dépôts d’immunoglobulines et de complément autour des capillaires dermiques superficiels et moins souvent à la jonction dermo-épidermique.
Figure 13. Décollement dermo-épidermique sous-épidermique avec une bulle acellulaire.
Figure 14. Plancher festonné de la bulle sous-épidermique.
La recherche de cofacteurs participant à la physiopathologie de la PCT est indispensable d’où la nécessité d’un bilan ferrique, éventuellement la recherche d’une hémochromatose, des sérologies des hépatites, du VIH, sans oublier le bilan hépatique et la numération formule sanguine.
DIAGNOSTIC DIFFÉRENTIEL
La porphyrie variegata partage avec la PCT le même tableau dermatologique. Il s’y associe les signes abdominaux (douleurs, vomissements, constipation) et neurologiques (fatigabilité musculaire, confusion, coma) observés également dans la porphyrie aiguë intermittente. Il n’y a pas de parallélisme entre les signes viscéraux et les manifestations dermatologiques qui peuvent les précéder de plusieurs années. Il s’agit d’une affection autosomique dominante liée à un déficit enzymatique en protoporphyrinogène oxydase dans les lymphocytes et les fibroblastes. Le rapport uroporphyrines/coproporphyrines urinaire est différent. Il existe une élévation fécale de protoporphyrine. Les hémodialysés peuvent avoir de véritables porphyries devant faire rechercher une infection associée par les virus des hépatites ou des pseudoporphyries avec un tableau clinique comparable sans les anomalies biologiques typiques de la PCT. Le diagnostic biologique peut être hésitant dans ce dernier cas, car la majorité des hémodialysés, qu’ils aient ou qu’ils n’aient pas de manifestations cutanées, ont une augmentation discrète des taux sanguins de porphyrines et parfois un déficit modéré en UROD. En cas de dialyse péritonéale ambulatoire, l’élévation des porphyrines est habituellement plus faible sans déficit en UROD. Des réactions cutanées de photosensibilité médicamenteuse peuvent donner des tableaux cliniques voisins de la PCT, sans hypertrichose ni trouble pigmentaire. Les médicaments incriminés sont les cyclines, l’acide nalidixique, le furosémide, la disulone, la naprosyne... Le dosage biologique des porphyrines est normal. Enfin, l’épidermolyse bulleuse acquise partage avec la PCT la présence d’une fragilité cutanée, de bulles sur les zones traumatisées et de grains de milium. Elle en diffère par la possibilité d’une atteinte muqueuse, les résultats de la biopsie cutanée, de l’immunofluorescence directe, de l’immunomicroscopie électronique, la fréquente association à une entéropathie inflammatoire et l’absence d’anomalies des porphyrines.
TRAITEMENT
L’évitement de l’exposition solaire, en particulier des radiations de 400-410 nm de longueur d’onde, est souhaitable, cependant incompatible avec une vie normale. Aussi est-il recommandé aux patients atteints de PCT de s’habiller avec des vêtements couvrants (chapeau, manches longues...). Pour les zones exposées, les écrans efficaces pour le visible sont recommandés notamment ceux contenant du zinc et de l’oxyde de titane.
L’évitement des facteurs favorisants tels que l’alcool, les œstrogènes est aussi important. Un régime pauvre en fer est recommandé ; la viande rouge et le foie étant déconseillés du fait de leur richesse en hème. Les traitements anti-viraux du VHC peuvent amener la guérison de la PCT en même temps que celle de l’hépatite(7).
L’absence de régression clinique avec ces mesures préventives conduit à utiliser un traitement symptomatique de la PCT (saignées ou antipaludéens de synthèse essentiellement).
Les saignées permettent une déplétion ferrique. Une soustraction de 300 à 500 cc par semaine ou toutes les 2 semaines est préconisée jusqu’à ce que la ferritine soit inférieure à 25 ng/ml. Avant chaque saignée, l’hémoglobine ne doit pas descendre au-dessous de 11 g/dl. La rémission clinique, généralement présente dès la soustraction de 2 à 4 litres de sang, précède la rémission biologique. Les bulles disparaissent en 2-3 mois, la fragilité cutanée en 6-9 mois ; la rémission biologique est obtenue en 13 mois environ. Un traitement d’entretien avec une saignée mensuelle n’est pas indispensable. Une anémie préexistante, un déficit protéique, éventuellement liés à une cirrhose ou à une maladie hémorragique, sont des contre-indications relatives aux phlébotomies.
Les antipaludéens de synthèse sont habituellement prescrits à faible dose (125 mg de chloroquine ou 100-200 mg d’hydroxychloroquine, 2 fois par semaine). Ils se lient aux porphyrines 7 et 8-carboxylées, s’accumulant dans les lysosomes, formant des complexes solubles, éliminés des tissus dans les urines. Ils inhibent l’acide delta-aminolévulinique synthétase. Une augmentation transitoire des transaminases et des porphyrines est fréquente lors de l’initiation du traitement, habituellement modérée, disparaissant en 2 mois. La rémission clinique est obtenue en 3 mois ; le traitement est poursuivi 2 à 18 mois avec normalisation des porphyrines en 4 à 16 mois. À fortes doses, ils provoquent la lyse des hépatocytes. Des schémas thérapeutiques avec de fortes doses sur une courte période (750 mg/j d’hydroxychloroquine pendant 3 jours), éventuellement précédés de phlébotomies, ont été proposés ; ils doivent être écartés en raison de l’hépatotoxicité. Les patients homozygotes pour la mutation C282Y seraient moins répondeurs que les hétérozygotes avec les antipaludéens.
Le risque de récidive a été évalué entre 5 et 17/100 années-malades, moins élevé en cas de saignées(8).
La desferrioxamine (Desféral®) est utile en cas de contre-indication des saignées (anémie réfractaire ou hémolytique). Ses effets thérapeutiques sont comparables à ceux des saignées qu’elle soit administrée par voie sous-cutanée lente (40-50 mg/kg en 8-10 heures, 5 jours sur 7 jusqu’à la rémission biologique puis 5-10 jours tous les 2 mois) ou par voie intraveineuse (200 mg/kg dans 500 ml de sérum physiologique, une fois par semaine). Les chélateurs oraux, tels que la défériprone (Ferriprox®), peu- vent être aussi prescrits surtout en cas de ferritine très élevée. Ils ont été efficaces dans des petites séries ou dans des cas cliniques isolés. D’autres traitements ont des indications exceptionnelles : plasmaphérèses, vitamine E... L’érythropoïétine est parfois utile notamment chez le dialysé avec épuration du fer lors des dialyses. La transplantation rénale peut s’accompagner de la guérison de la PCT.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :