Publié le 25 juin 2019Lecture 10 min
Infections cutanées bactériennes - L’essentiel des dernières recommandations
C. FRANCÈS, Service de dermatologie-allergologie, UF de dermatologie vasculaire, Hôpital Tenon, Paris
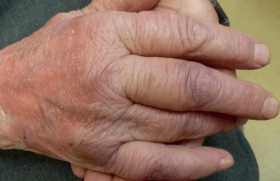
Des recommandations de bonne pratique ont été publiées en février 2019 concernant la prise en charge des infections cutanées bactériennes courantes. Ces recommandations, éditées par l’HAS, ont été faites avec la Société française de dermatologie et la Société de pathologie infectieuse de langue française. Nous rappellerons brièvement les principaux messages. Pour plus d’informations, connectez-vous sur le site de l'HAS.
Les inhibiteurs de check-point immunologiques (anti-PD-1, anti-PD-L1, anti-CTLA-4) représentent aujourd’hui un traitement majeur de nombreux cancers métastatiques ou localement avancés, notamment dermatologiques (mélanome, carcinome épidermoïde, tumeur de Merkel). Leur utilisation en situation adjuvante est aussi rapidement croissante, notamment dans le mélanome. Du fait de leur mécanisme d’action particulier, visant à stimuler l’activation T-lymphocytaire cytotoxique, ils s’associent à un profil de toxicité tout à fait spécifique caractérisé par le développement d’effets indésirables de type « dysimmunitaire »(1). Si le rapport bénéfice-risque peut être considéré comme favorable, n’importe quel organe peut — en théorie — être concerné par ce type de toxicités, communément appelées « immune-related adverse events » : colite, hépatite, thyroïde, hypothysite, myocardite…Dans ce sens, la toxicité dermatologique est la plus fréquente, avec près d’un tiers des patients traités par anti-PD-1 qui sont concernés(2-4). Elle reste cependant limitée dans la grande majorité des cas, avec moins de 3 % de grade ≥ 3(2). Elle peut toutefois persister longtemps après l’arrêt du traitement inducteur (notamment les atteintes lichénoïdes)(2,3). Ces manifestations dermatolo-giques induites sont grossièrement comparables entre anti-PD-1 (nivolumab, pembrolizumab), anti-CTLA-4 (ipilimumab) et anti-PD-L1 (atezolizumab, durvalumab, avelumab), même si l’incidence varie en fonction des classes thérapeutiques (plus élevée avec les anti-CTLA-4, moindre avec les anti-PD-L1). Enfin, il a été suggéré que la survenue de symptômes dermatologiques dans ce contexte serait associée à une meilleure réponse antitumorale, que ce soit en termes de réponse objective ou de survie globale(5,6). Cette donnée reste à confirmer et apparaît établie, surtout pour les patients traités pour un mélanome qui développent un vitiligo.
TOXICITÉ DERMATOLOGIQUE DES INHIBITEURS DE PD-1/PD-L1
Elle est avant tout secondaire à la réactivation T-lymphocytaire CD4/CD8+ induite, avec possible « homing » cutané après ciblage aberrant d’antigènes dermiques qui restent à déterminer. Une stimulation de certaines voies de signalisation cytokiniques (Il17 par exemple) ou d’autoanticorps préexistants peut aussi être suspectée dans certaines de ces manifestations(1).
Exanthème maculo-papuleux
Présentation et formes cliniques
Il s’agit de la manifestation dermatologique la plus fréquente, affectant près de 15 % des patients traités par anti-PD-1 en monothérapie(2,3). Il est moins fréquent avec les anti-PD-L1. Les lésions apparaissent progressivement après 4 à 6 semaines de traitement(2,3) et prédominent sur le tronc, le cuir chevelu ou la face d’extension des membres, avec un respect relatif du visage (figures 1 et 2). Le prurit associé est souvent au premier plan (cf plus loin). Les lésions ne sont pas spécifiques, avec des maculo-papules de petite taille, plus ou moins confluentes.
Lorsqu’une biopsie cutanée est réalisée, le pattern histologique le plus souvent individualisé est de type eczématiforme, avec spongiose(2). Un infiltrat lymphocytaire T péri-vasculaire (CD4+ ou CD4/CD8+) est fréquent, parfois avec exocytose, ainsi que la présence d’éosinophiles et de quelques nécroses kératinocytaires. Cependant, un aspect lichénoïde peut être associé, avec agression de la basale et dermite d’interface avec infiltrat T-lymphocytaire sous-épithélial en bande et apoptose kératinocytaire. Ces réactions lichénoïdes peuvent également survenir de façon isolée(2,5), les lésions cutanées étant alors volontiers associées à une atteinte palmo-plantaire et/ou muqueuse, notamment buccale (figures 3 et 4). Une acantholyse supra-basale peut aussi représenter la principale modification histologique, en rapport en général avec une atteinte de type « Grover-like ».
Il ne faut pas non plus méconnaître une toxicité plus grave débutante, de type Stevens-Johnson, nécrolyse épidermique toxique, DRESS ou érythème polymorphe, qui reste relativement exceptionnelle avec ces molécules, mais qui peut survenir de façon retardée(2). Enfin, cet exanthème peut aussi représenter la première manifestation d’une toxicité dermatologique plus caractéristique de type psoriasis ou pemphigoïde bulleuse (cf plus loin), et qui peut être difficile à individualiser ou à évoquer pour le non-dermatologue.
En synthèse, Il apparaît nécessaire d’adresser le patient au dermatologue devant toute symptomatologie sévère, persistante ou atypique pour une caractérisation clinique et histologique plus précise de l’éruption, et afin de proposer une prise en charge adaptée.
Prurit
Il concerne 15 à 20 % des patients sous anti-PD-1(2,3). Son incidence est moindre avec les anti-PD-L1 mais plus élevée avec l’ipilimumab (seul ou en association)(4). Même si les formes sévères sont rares (< 1 % de grade 3), le prurit domine souvent le tableau clinique (figure 5) et peut significativement impacter sur la qualité de vie du patient(7). Il accompagne en général un exanthème maculo-papuleux, mais il peut aussi survenir seul ou rester longtemps isolé. Les principaux bastions sont le tronc et la face antérieure des membres(7).
Prise en charge
Le traitement repose avant tout sur des mesures symptomatiques avec dermocorticoïdes, émollients et/ou antihistaminiques sédatifs. Il faut systématiquement corriger une cause associée de prurit, qu’elle soit locale (xérose et altération de la fonction barrière) ou générale (cholestase par exemple). De même, il faut éliminer une pemphigoïde bulleuse induite débutante (voir plus loin).
En cas d’amélioration insuffi-sante, il convient de caractériser l’éruption, notamment au niveau histologique, et de proposer une prise en charge adaptée si nécessaire. Dans ce cadre, les rétinoïdes ou la photothérapie UVB ont été proposés (de façon non contrôlée) pour les formes lichénoïdes, ainsi que l’aprepitant pour le prurit rebelle. La vitamine D3 topique peut être prescrite en cas de maladie de Grover induite.
L’arrêt de l’immunothérapie reste rarement nécessaire. L’utilisation d’une corticothérapie systémique est à réserver aux formes sévères et/ou réfractaires, et après avoir éliminé une atteinte dermatologique spécifique nécessitant une prise en charge plus adaptée (psoriasis par exemple).
Psoriasis
Le risque de survenue d’un psoriasis est bien établi avec les anti-PD-1 ou les anti-PD-L1. Il s’agit le plus souvent d’un psoriasis survenant ou s’aggravant chez des patients avec antécédents personnels ou familiaux de psoriasis, plus rarement d’un psoriasis de novo(2,8). Il peut s’agir d’un psoriasis vulgaire (figure 6 a et b) mais d’autres présentations sont possibles et peuvent induire en erreur le clinicien : formes inversées, atteinte palmo-plantaire, lésions nummulaires ou pustuleuses, sebo-psoriasis, atteinte unguéale exclusive. Un rhumatisme psoriasique peut aussi apparaitre. Les mécanismes physiopathologiques restent à préciser mais une stimulation de l’axe Il17, secondaire à l’inhibition de PD-1, a été cependant suggérée(1,2).
Le traitement repose avant tout sur les traitements topiques (dermocorticoïdes, vitamine D3), et l’immunothérapie peut être poursuivie dans la majorité des cas. Pour les formes plus sévères, l’introduction d’une photothérapie UVB, de l’apremilast, du methotrexate, de l’acitrétine ou d’une biothérapie (anti-Il17 par exemple) doit se discuter de façon pluridisciplinaire.
Vitiligo
Il s’agit d’une manifestation classique des inhibiteurs de check-point immunologiques. Il est plus fréquent avec les anti-PD-1 qu’avec les anti-PD-L1 ou anti-CTLA-4, avec une incidence globale moyenne de 8 %(2,3). Il faut noter qu’il se développe très majoritairement chez les patients traités pour un mélanome. Les lésions apparaîssent après quelques mois de traitement. Elles n’ont pas toujours une distribution bilatérale (figure 7) et prédominent parfois sur les zones photo-exposées, ou autour de métastases cutanées. Une phase inflammatoire initiale peut être notée. Un phénomène de Sutton avec halo-nævus peut aussi être observé. Une dépigmentation associée des cheveux ou des cils/sourcils, avec achromotrichie, n’est pas rare.
Le mécanisme le plus souvent évoqué est une réaction croisée T-lymphocytaire sur des antigènes exprimés à la fois par les mélanocytes malins et normaux (gp 100, MART-1, tyrosinase). La description croissante, cependant, de cas de vitiligo chez des patients traités pour des tumeurs non mélanocytaires suggère la participation d’autres mécanismes pathogéniques.
Une repigmentation lente et progressive peut être observée après arrêt du traitement, parfois concomitante d’une récidive tumorale. Il faut cependant bien informer les patients, notamment en cas de traitement adjuvant, de la possibilité de formes profuses et persistantes. Enfin, il apparaît que le développement d’un vitiligo dans ce contexte soit corrélé à une meilleure réponse antimorale, que ce soit en termes de réponse objective ou de survie globale(6).
Dermatoses auto-immunes
Les inhibiteurs de checkpoint peuvent clairement favoriser une poussée de maladie auto-immune préexistante(8). Ils peuvent aussi s’associer à l’apparition d’une nouvelle maladie auto-immune, notamment dermatologique. Il peut alors s’agir d’une pemphigoïde bulleuse, d’une dermatomyosite, d’un syndrome de Sjögren, d’une vasculite avec nécroses digitales ou d’un lupus subaigu(2).
La pemphigoïde bulleuse représente la dermatose auto-immune la plus fréquemment induite par les anti-PD-1/PD-L1 (hors psoriasis), avec une incidence très approximative de 1 %(9). L’exacerbation d’une pemphigoïde bulleuse préexistante est aussi classique. Cette dermatose bulleuse induite apparait potentiellement liée à la stimulation par l’immunothérapie d’auto-anti-corps présents avant le début du traitement ou par une activation croisée contre certains antigènes (BP 180) exprimés aussi parfois par certaines cellules tumorales(1,9). Elle peut se manifester initialement par un exanthème maculo-papuleux très prurigineux, persistant plusieurs semaines avant l’apparition de bulles (figure 8). En conséquence, sa recherche doit être systématique en cas de prurit sévère persistant. Une atteinte muqueuse est aussi possible. L’immunofluorescence directe est le plus souvent positive, avec dépôts linéaires le long de la membrane basale. L’analyse en ELISA individualise en général des anticorps anti-BP 180. Diffé-rentes options thérapeutiques ont été proposé, notamment la corticothérapie (topique ou systémique), le méthotrexate, l’omalizumab, les cyclines ou le rituximab(9). La reprise de l’immunothérapie doit se discuter au cas par cas et de façon collégiale, prenant en compte la sévérité des lésions et la réponse thérapeutique anti-tumorale obtenue. D’autres dermatoses bulleuses auto-immunes ont été beaucoup plus exceptionnellement décrites dans ce contexte, notamment une pemphigoïde des muqueuses, un lichen plan pemphigoïde, une dermatose à IgA linéaire, une dermatite herpétiforme ou la détection isolée d’anticorps anti-desmogleine ou anti-plakines.
Sarcoïdose
Les inhibiteurs de checkpoint immunologiques favorisent aussi le développement ou l’exacerba-tion de réactions granuloma-teuses sarcoïdosiques(2). L’atteinte cutanée n’est pas rare, survenant de façon isolée ou plus souvent en association avec une atteinte systémique, notamment pulmonaire. La forme la plus courante est l’apparition de nodules profonds dermiques, avec granu-lome sarcoïdosique. De nombreuses autres formes ont été cependant rapportées : annu-laires, sur cicatrices, sur tatouage, avec papules ou plaques confluentes. La survenue d’un érythème noueux (figure 9), d’un syndrome de Löfgren ou d’une panniculite avec granulomes est aussi possible dans ce contexte. Le traitement repose avant tout sur la corticothérapie orale ou topique, en fonction du tableau clinique.
Toxicités endobuccales
Une xérostomie est notée dans moins de 10 % des cas, selon les séries. En pratique, cette atteinte est probablement beaucoup plus fréquente. Des formes sévères, nécessitant l’arrêt de l’immuno-thérapie, sont possibles. Elles sont exceptionnellement en rapport avec une véritable maladie de Sjögren.
La survenue d’une réaction liché-noïde endobuccale avec les anti-PD1/PD-L1 est encore plus caractéristique(10). Il peut s’agir d’une forme réticulée, atrophique, en plaques ou érosive (figure 4). Elle survient de façon isolée ou associée à une atteinte cutanée ou phanérienne. La prise en charge est symptomatique.
Toxicités sur le follicule pileux
Une alopécie est notée dans moins de 2 % des séries. Il s’agit avant tout d’une alopécie en rapport avec un mécanisme peladique immuno-médié, qui peut être extensive et parfois de type universelle(2). Ceci doit être signalé, notamment en situation adjuvante. Une poliose est souvent notée lors de la repousse. Une modification ou une repig-mentation des cheveux a aussi été sporadiquement rapportée.
Autres
De nombreux autres tableaux dermatologiques ont été beaucoup plus rarement décrits en association avec les inhibiteurs de checkpoint immunologiques(2). L’imputabilité n’est pas toujours établie. On peut citer : rosacée papulo-pustuleuse, kéaroacan-thomes/carcinomes épidermoïdes éruptifs, inflammation de kératoses séborrheiques, fasciite à éosinophiles, sclérose cutanée diffuse, syndrome de Sweet ou pyoderma gangrenosum, granulome annulaire…
TOXICITÉ DERMATOLOGIQUE DE LA COMBINAISON ANTI-PD-1/CTLA-4
Le profil des toxicités observées avec l’association nivolumab/ipili-mumab est globalement compa-rable à celui des inhibiteurs PD-1 ou anti-CTLA-4 utilisés en mono-thérapie. En revanche, ces toxi-cités sont à la fois plus précoces, plus fréquentes et plus sévères en combinaison(4). C’est notamment vrai pour les effets indési-rables dermatologiques, avec près de 2/3 des patients concernés, dont près de 7 % avec un grade ≥ 3(2,4). Par exemple, l’incidence — tous grades — des exanthèmes ou du prurit est d’au moins 30%. Il faut souligner que cette toxicité est significativement supérieure avec le schéma nivo-lumab (1 mg/kg)/ipilimumab (3 mg/kg) développé dans le mélanome, en comparaison avec les schémas utilisés dans le cancer du rein ou du poumon (respecti-vement 3 mg/kg et 1 mg/kg). Une surveillance rapprochée des patients doit être proposée. De même, la réintroduction d’un anti-PD-1 après toxicité sévère initiale avec la combinaison, doit être prudente.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :