Publié le 11 sep 2017Lecture 16 min
Du bon usage de l’hydroxychloroquine
Camille FRANCÈS, François CHASSET, Hôpital Tenon, Paris
L’hydroxychloroquine est actuellement l’antimalarique le plus prescrit dans les maladies inflammatoires cutanées. Connaître ses effets secondaires et leur prévention est un préalable indispensable à leur prescription.
L’hydroxychloroquine (HCQ) ou Plaquenil® est largement prescrite en dermatologie pour traiter notamment les lupus cutanés, les sarcoïdoses, les atteintes cutanées de dermatomyosite ou les lucites polymorphes. Il est le traitement de fond du lupus systémique. En France, environ 30 000 patients sont traités par les antipaludéens de synthèse (APS) au long cours ; plus de 95 % par l’HCQ et moins de 5 % par la chloroquine. L’HCQ a peu à peu supplanté la chloroquine (CQ) en raison d’une moindre toxicité, en particulier oculaire. Le maniement de ce médicament nécessite une connaissance de son métabolisme et de ses effets secondaires pour mieux les appréhender et les prévenir.
Pharmacologie et métabolisme
En France, le sulfate d’HCQ est commercialisé sous forme de comprimé à 200 mg (Plaquenil®) contenant 155 mg d’équivalent de base (prix du comprimé : 0,18 €).
Cet antipaludéen a une excellente absorption après administration orale de l’ordre de 78 à 89 %. L’absorption se fait au niveau du duodénum et du grêle proximal ; elle est favorisée par l’alimentation. Le pic plasmatique est atteint en 1 h 30. Dans le plasma, environ 50 % de l’HCQ est lié aux protéines (albumine et alfa glycoprotéine). La distribution tissulaire est large avec une forte affinité pour les tissus pigmentés, riches en mélanine comme la peau et la rétine. Les taux observés au niveau du tissu adipeux, de l’os ou des tendons sont très inférieurs aux taux plasmatiques (environ 1/10 de la concentration sanguine dans le tissu adipeux) d’où les recommandations d’adapter les doses prescrites en fonction du poids corporel idéal et non en fonction du poids absolu chez les sujets en surpoids. Le poids idéal peut être calculé avec la formule suivante :
– chez l’homme : (taille en cm – 100) – 10 % ;
– chez la femme : (taille en cm – 100) – 15 %.
L’HCQ est partiellement métabolisée dans le foie par le cytochrome P 450 avant d’être éliminée par le rein. À posologie quotidienne constante, les taux sériques augmentent très rapidement la première semaine, puis s’équilibrent et atteignent un taux constant en 4 à 6 semaines.
Les APS sont caractérisés par une longue demi-vie d’élimination estimée à environ 40 jours mais peuvent rester accumulés dans les tissus et ainsi être détectés après une longue période pouvant atteindre 5 ans après l’arrêt des prises(1).
Mécanismes d'action
Les mécanismes d’action de l’HCQ ne sont que partiellement éclaircis(2). Ses actions, immunomodulatrice et anti-inflammatoire, sont liées à différents mécanismes :
– une action antagoniste sur les TLR (Toll like receptors), en particulier TLR-7 et TLR-9 inhibant la synthèse d’IFN-α par les cellules dendritiques plasmacytoïdes ayant un rôle majeur dans la physiopathologie des lupus cutanés. Cette action provient d’un mécanisme de gène stérique inhibant la liaison entre les TLR et les complexes immuns contenant de l’ADN et de l’ARN sur les lysosomes sans inhiber la protéolyse endosomale ni jouer sur l’acidification des lysosomes ;
– une diminution de la production de cytokines par les macrophages et les cellules dendritiques notamment de l’IL-6 ;
– une inhibition de la prolifération lymphocytaire T ;
– une inhibition de la phospholipase A2, avec un effet antiprostag landine ;
– une inhibition de la signalisation calcique au sein des lymphocytes B et T perturbant l’immunité adaptative ;
– une action sur la voie des métalloprotéinases rétablissant ainsi l’homéostasie cellulaire ;
– un effet protecteur anti-UVA, anti-UVB.
Son effet photoprotecteur est expliqué partiellement par une action anti-inflammatoire locale d’où une diminution de l’infiltration dermique lymphocytaire. Il active également la transcription du gène c-Jun qui a une action protectrice précoce contre les UV en induisant la réparation des dégâts tissulaires liés aux UV. Il se lie à l’ADN avec une action stabilisante ; il empêche ainsi la formation des D-dimères de thymine. Enfin, il limite l’apoptose cellulaire induite par les rayonnements.
En dehors de son action antiinfectieuse, l’HCQ a aussi d’autres propriétés bénéfiques telles qu’un effet hypolipémiant par diminution de la synthèse intrahépatique de cholestérol, accumulation de LDL dans les lysosomes, effet antithrombotique par diminution de l’agrégation plaquettaire, réduction de la formation du complexe antiphospholipide-ß2 glycoprotéine à la surface des phospholipides, observée pour des concentrations sanguines d’HCQ supérieures à 1 000 ng/ml, effet hypoglycémiant par augmentation de la sécrétion de l’insuline et de l’affinité des récepteurs périphériques à l’insuline.
Faut-il faire un bilan sanguin avant prescription d'HCQ ?
Il est classique de dire que les APS peuvent induire une hémolyse chez les sujets ayant un déficit en glucose 6 phosphate déshydrogénase (G6PD) ; en fait, cet évènement n’a pas été signalé avec l’HCQ.
Les APS sont indiqués en alternative ou en complément des saignées dans le traitement de la porphyrie cutanée tardive. Ils agissent par formation de complexes hydrosolubles avec les porphyrines hépatiques, permettant un accroissement de leur excrétion urinaire. Dans cette affection, les doses habituelles d’HCQ peuvent provoquer une hépatite cytolytique d’où l’habitude de prescrire de faibles doses (100 à 200 mg 2 fois par semaine).
La rareté de la PCT et du déficit en G6PD ne justifie pas leur détection systématique avant tout traitement d’HCQ. En revanche, la prescription d’HCQ chez des malades avec un diagnostic préalable de PCT ou de déficit en G6PD sera initiée à faible dose avec contrôle de la numération formule sanguine et du bilan hépatique.
Concentration sanguine de l'HCQ
Des dosages sanguins de l’HCQ sont possibles sur prélèvement de sang total par des techniques de chromatographie. Ce dosage a un intérêt majeur pour dépister la non-observance du traitement. Environ 10 % des patients sur 300 atteints de lupus cutanés avaient des taux sanguins d’HCQ inférieurs à 200 ng/ml, taux incompatibles avec une prise régulière(3). Cette nonobservance est parfois totalement imprévisible et non avouée. Chez les sujets avec des taux sanguins entre 200 et 750 ng/ml, il n’est pas possible de faire la part entre une moins bonne absorption, un catabolisme exagéré et/ou une observance partielle. Dans le lupus cutané, nous avons démontré qu’il existe une corrélation entre les taux sanguins d’HCQ et la fréquence des rémissions cliniques(3). Chez les malades avec un taux sanguin bas d’HCQ (≤ 750 ng/ml), l’augmentation transitoire de 200 mg de la dose d’HCQ prescrite pendant 3 à 6 mois a permis d’obtenir dans environ un tiers des cas une rémission durable sans ajout d’un autre traitement systémique(4).
Les taux sanguins d’HCQ sont indépendants de la prise de nombreux médicaments pris conjointement tels que les inhibiteurs ou activateurs du cytochrome P450, les antiacides, les antiagrégants, anticoagulants, inhibiteurs de la pompe à protons, inhibiteurs de l’enzyme de conversion de l’angiotensine, indépendants également d’une éventuelle intoxication tabagique, de l’ethnie, de la dose identique quotidienne ou variable 1 j/2, de la prise unique ou 2 fois par jour. Les facteurs augmentant les résultats du dosage sont une diminution de la clairance de la créatinine, un délai court entre la prise du médicament et le dosage (d’où le conseil de ne pas prendre la dose du matin avant le dosage), un index de masse corporelle bas, ceux le diminuant étant un abaissement du taux de plaquettes et des neutrophiles(5).
La variabilité interindividuelle de la concentration d’HCQ est également corrélée à l’absorption, au métabolisme de chacun, à la liaison aux protéines plasmatiques. Aussi, nous recommandons de faire un dosage sanguin d’HCQ devant tout malade réfractaire à un traitement par HCQ d’au moins 3 mois avant de modifier la stratégie thérapeutique. En cas de dosage inférieur à 200 ng/ml, il est nécessaire de combattre l’inobservance ; en cas de dosage entre 200 et 750 ng/ml, une augmentation de la dose prescrite de 200 mg peut être tentée pendant 3 mois avec retour à la dose normale (6,5 mg/kg de poids idéal) secondairement afin d’éviter une éventuelle toxicité oculaire.
Grossesse et allaitement
La notice du Plaquenil® dans le Vidal et le Centre de Référence des Agents Tératogènes indiquent que l’utilisation de l’HCQ pendant la grossesse n’est envisageable que si l’arrêt du traitement expose la femme enceinte à une poussée évolutive de sa pathologie. Or, ce médicament est poursuivi pendant la grossesse systématiquement chez les femmes avec un lupus systémique depuis plus de 10 ans sans qu’aucun effet secondaire n’ait été signalé chez l’enfant. Il prévient les poussées lupiques pouvant être induites par la grossesse. De même, chez les femmes ayant un lupus cutané, l’HCQ prévient le risque d’aggravation du lupus cutané ainsi que celui d’une éventuelle transformation du lupus cutané en lupus systémique pouvant être induite par la grossesse. Aussi est-il habituel de poursuivre le traitement chez les malades qui bénéficient de ce traitement quelle que soit la pathologie pour laquelle il a été prescrit. L’HCQ diminuerait également le risque d’atteinte cardiaque des fœtus de mère ayant des anticorps anti-RO/SSA ou anti-La/SSB avec un premier enfant atteint de lupus néonatal cardiaque(6).
L’allaitement est contre-indiqué dans la notice du Vidal mais autorisé par le Centre de Référence des Agents Tératogènes. Les concentrations retrouvées dans le lait maternel sont très basses comparativement à celles du sang de cordon ombilical, l’allaitement maternel correspondant à une ingestion inférieure à 0,2 mg/kg/j(7). Ainsi, la quantité d’HCQ reçue par l’enfant vial’allaitement est faible comparée à celle reçue in utero. Il n’est ainsi pas logique de contre-indiquer l’allaitement quand l’HCQ a été maintenu pendant la grossesse.
Effets secondaires de l'HCQ
En général, l’HCQ est bien toléré ; toutefois de nombreux effets secondaires ont été rapportés, le plus redouté étant la toxicité oculaire.
Toxicité oculaire
L’HCQ ayant une haute affinité pour la mélanine, il s’accumule au niveau oculaire dans la rétine, l’iris, la choroïde, et les corps ciliaires.
Les dépôts d’HCQ dans la cornée, beaucoup moins fréquents que ceux de CQ, sont souvent asymptomatiques (détection à la lampe à fente) ou peuvent donner une vision floue, une photophobie, des halos visuels ; ils disparaissent généralement malgré la poursuite du traitement et ne préjugent pas d’une rétinopathie associée.
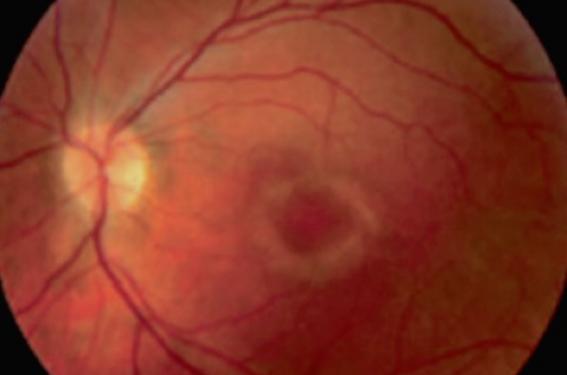
La toxicité rétinienne des APS se caractérise par une atteinte bilatérale et relativement symétrique de la macula, qui, en l’absence de dépistage systématique, peut passer longtemps inaperçue, car asymptomatique. La rétinopathie provoque au long cours une baisse d’acuité visuelle bilatérale progressive, pouvant conduire à la cécité. Elle est réversible à un stade précoce, d’où l’intérêt du dépistage systématique. La classique maculopathie en « œil de bœuf », (figure 1) visible au fond d’œil, caractéristique de l’intoxication aux APS à un stade clinique, ne devrait plus être observée.
Figure 1. Aspect au fond d'œil de la maculopathie en œil de bœuf
qui ne devrait plus être observée aujourd'hui.
• Moyens de dépistage de la toxicité oculaire à un stade préclinique
Le dépistage de la rétinopathie préclinique comporte habituellement un test subjectif et un test objectif(8).
Le test subjectif est le champ visuel automatisé des 10° centraux qui nécessite la participation du malade. Il montre une baisse focale et bilatérale paracentrale du seuil de sensibilité rétinien dès les stades précoces avec un bon seuil de sensibilité fovéolaire (épargne fovéolaire). Cet examen, très sensible, est largement disponible ; cependant, il est peu spécifique et subjectif pouvant varier chez le même individu d’un moment à l’autre. Les yeux asiatiques doivent être testés avec un champ visuel plus large, “24-2” ou “302”, du fait de la possibilité d’une atteinte rétinienne plus périphérique(9).
Les tests maculaires objectifs comportent :
– La tomographie par cohérence optique haute définition permettant d’avoir une coupe anatomique de la rétine, avec analyse des différentes couches. Les signes d’atteintes précoces sont un amincissement de la couche des photorécepteurs de la zone périfovéolaire et une interruption de la ligne de jonction des segments internes/externes des photorécepteurs (en particulier les cônes) de la région périfovéolaire. C’est un examen simple à réaliser, d’une grande sensibilité et spécificité, proposé en première intention avant l’électrorétinogramme lorsqu’il est disponible.
– L’électrorétinogramme multifocal (ERG mf), examen fonctionnel de la rétine, exigeant une fixation stable de la cible par le malade, la pose d’une correction optique par une lentille, parfois désagréable voire impossible en cas de syndrome sec, une dilatation pupillaire. L’ERG est probablement un des examens les plus sensibles ; il détecte des modifications électriques maculaires précoces avec diminution de l’amplitude des réponses dans la zone paracentrale, principalement en inférieur du point de fixation, zone privilégiée d’atteinte toxique aux APS. La disponibilité de cet examen est restreinte à des centres spécialisés, ne pouvant être réalisé que par des personnes entraînées.
– Les clichés en autofluorescence du fond d’œil, simple et rapide pouvant montrer des altérations précoces de l’épithélium rétinien pigmentaire avec un anneau péricentral hyperfluorescent correspondant à des débris des segments externes des photorécepteurs et à une accumulation de lipofuscine. À un stade plus évolué, il montre, en revanche, une perte en motte de l’autofluorescence péricentrale avec un aspect sombre témoignant de zones atrophiques rétiniennes dépourvues de photorécepteurs. Cet examen, moins sensible pour un diagnostic précoce que l’OCT ou l’ERG est un bon outil pronostique et de suivi, car il peut prédire l’évolution de cette rétinopathie à l’arrêt du médicament.
– L’imagerie optique adaptative, nouvelle technique, peu répandue, permettant de visualiser les photorécepteurs in vivo.
• Prévalence de la toxicité rétinienne préclinique et facteurs de risque
La prévalence de la toxicité rétinienne préclinique a été estimée à 7,5 % sur 2 361 malades traités par HCQ depuis plus de 5 ans avec une surveillance oculaire homogène selon les recommandations américaines(10). Une dose ingérée > 5 mg/kg de poids réel augmentait le risque de cette toxicité. Pour réduire ce risque, la dose quotidienne ingérée doit être inférieure à 5 mg/kg/j, ce qui correspond en France à la dose prescrite recommandée de 6,5 mg/kg de poids idéal ([taille en cm -100] – 10 % chez l’homme et 15 % chez la femme), compte tenu qu’en moyenne, les patients sont en surpoids et partiellement observants (prise ingérée environ de 80 % de la dose prescrite). À cette dose, le risque de toxicité oculaire est très faible dans les 5 premières années, restant au-dessous de 2 % après 10 ans de traitement, augmentant à 20 % après 20 ans de traitement. Les autres facteurs de risque de toxicité oculaire sont l’insuffisance rénale (chute de 50 % de la clairance de la créatinine x 2 ce risque) et la prise concomitante de tamoxifène, probablement par une action synergique, le tamoxifène étant également toxique pour la rétine.
• Surveillance oculaire d’un traitement par HCQ
En pratique, selon les recommandations américaines, actualisées en 2016, avant la mise en route du traitement ou au plus tard dans les 6 premiers mois de traitement, un examen de référence est souhaitable comprenant la mesure de la meilleure acuité visuelle corrigée, un fond d’œil, pupilles dilatées, afin d’éliminer une maculopathie préexistante qui pourrait constituer une contre-indication à la mise en route du traitement, et les examens de référence qui serviront pour dépister une toxicité ultérieure. Ceux-ci associent un test subjectif tel le champ visuel automatisé et un examen objectif (tomographie par cohérence optique haute définition ou électrorétinogramme multifocal ou autofluorescence du fond d’œil). Ils seront contrôlés annuellement après cinq années d’exposition à l’HCQ ou annuellement dès le début du traitement pour ceux ayant au moins un facteur de risque d’intoxication aux APS. Ne sont plus recommandés pour le dépistage de la rétinopathie aux APS car peu sensibles : les rétinophotographies, servant uniquement au dépistage d’une maculopathie préexistante lors de l’examen de référence, la tomographie par cohérence optique, l’angiographie à la fluorescéine, l’électrorétinogramme global, la grille d’Amsler, le test de la vision des couleurs, l’électro-oculogramme. En cas de simple suspicion de toxicité, la lenteur de la progression de la rétinopathie préclinique permet de répéter les tests en centre spécialisé avant l’arrêt définitif de l’HCQ, indispensable en cas de confirmation. Il est souhaitable secondairement de contrôler les examens anormaux à 3 mois et annuellement jusqu’à stabilité des examens.
Toxicité digestive
Des troubles digestifs sont fréquents, surtout en début du traitement, diminués par la prise des 2 comprimés d’HCQ habituellement prescrits au milieu des 2 principaux repas ou le soir juste avant le coucher. Ils imposent rarement la diminution des doses, voire l’arrêt du traitement. Crampes, nausées, vomissements, diarrhées, douleurs abdominales ont ainsi été rapportés aussi bien avec la CQ que l’HCQ avec une prévalence de 5 à 18 % selon les séries(11). Ces effets sont en partie dus à une action de l’HCQ sur le muscle intestinal. Les APS ne sont en revanche pas responsables d’ulcères gastro-duodénaux malgré leur action sur les prostaglandines.
Toxicité cutanée
• Les pigmentations sont surtout visibles sur peau claire, de couleur bleu-vert, grisâtre, voire noire ou brun-jaune (figure 2). Elles sont localisées sur les jambes (face antérieure des tibias), pouvant toucher également les avant-bras, le visage, le lit de l’ongle, le palais dur et les gencives. Elles sont plus fréquentes en présence de facteur de risque d’hématomes (anticoagulant, antiagrégant, traumatismes), qui peuvent les précéder. Dans une étude de 25 cas, la durée moyenne de prise d’HCQ était de 6,1 ans (3 mois à 22 ans) et la dose cumulée d’HCQ de 36 à 3 168 g avec une moyenne de 720 g(12). Leur présence incite à dépister plus étroitement une autre toxicité, notamment oculaire et cardiaque. Elles sont stables ou peuvent s’estomper dans le temps, partiellement réversibles à l’arrêt du médicament.
Figure 2. Pigmentation sur les jambes apparue après 10 ans de traitement par HCQ.
• L’exacerbation d’un psoriasis (18 % sous APS) est classique, généralement accessible à un traitement médical.
• Le prurit aquagénique est un effet secondaire rare des APS (5,7 %), parfois très gênant, apparaissant 1 à 3 semaines après le début du traitement(13). Il débute quelques minutes suivant le contact de l’eau chaude ou froide, parfois intense pendant 10 minutes environ, s’atténuant secondairement pour disparaître en quelques heures. Il est insensible aux antihistaminiques, souvent diminué par un traitement bêtabloquant (propranolol 20 à 40 mg/j).
• Les exanthèmes maculopapuleux, rares, apparaissent dans les 3 premières semaines et régressent rapidement à l’arrêt du médicament, plus souvent observés en cas de dermatomyosite que de lupus traités à l’HCQ(14). Dans la moitié des cas, l’HCQ peut être remplacé par la CQ sans récidive de l’éruption. Une induction de tolérance avec de petites doses d’HCQ (0,1 mg/j initialement et augmentation progressive jusqu’à 400 mg/j) a été tentée avec succès.
• Des urticaires non allergiques par un mécanisme pharmaco- logique ont été observées, survenant plusieurs heures ou jours après le début du traitement et ne s’aggravant pas au cours du temps. Un seul cas de choc anaphylactique a été signalé avec secondairement une induction de tolérance réalisée avec succès.
• Les pustuloses exanthématiques aiguës généralisées (PEAG) sont exceptionnelles. Néanmoins, dans l’étude EuroSCAR de 2007, les APS (HCQ et CQ) étaient en 4eposition derrière la pristinamycine, les aminopénicillines et les quinolones parmi les médicaments incriminés(15). Environ une vingtaine de cas ont été rapportés à l’HCQ dans la littérature. Dans tous les cas, le délai de survenue de la PEAG est plus long que les délais habituels (< 48 h) avec un délai allant de 15 à 21 jours. L’amélioration des lésions a été rapide dans tous les cas, dans les 15 jours suivant l’arrêt du traitement.
• Le syndrome de StevensJohnson ou la nécrolyse épidermique sont encore plus rares (< 10 cas dans la littérature) avec un délai habituel de 15 jours. Les DRESS aux APS sont exceptionnels.
L’intérêt des tests cutanés pour explorer ces réactions cutanées médicamenteuses fait l’objet d’une étude prospective ; dans l’étude rétrospective, 14 des 14 patients testés avaient eu des tests cutanés négatifs, alors que le test de provocation orale a été positif dans 1 cas sur les 6 où il a été pratiqué(16).
L’achromotrichie (mèches blanches), le vitiligo, la radiosensibilité ont surtout été observés avec la CQ. La responsabilité des APS dans le déclenchement d’un effluvium télogène chronique est difficile à démontrer étant donné la multiplicité des causes possibles.
Toxicité cardiaque, musculaire, neurologique
La cardiotoxicité, incluant des troubles de la conduction et une insuffisance cardiaque congestive, est exceptionnelle avec l’HCQ, plus fréquente avec la CQ, généralement associée à d’autres toxicités, notamment musculaire, oculaire, neurologique et/ou des pigmentations cutanées. Le diagnostic repose sur les résultats de la biopsie endomyocardique ou musculaire lorsque cette dernière est contre-indiquée. Les aspects histologiques sont voisins avec une myopathie vacuolaire et des inclusions cytoplasmiques d’un matériel granuleux. Il n’y a aucune recommandation officielle concernant la surveillance cardiaque d’un traitement par HCQ. Un ECG au début du traitement puis annuellement après 5 ans de traitement ou en présence d’une autre toxicité paraît souhaitable(7).
La neuromyotoxicité est encore plus exceptionnelle, caractérisée par une faiblesse musculaire des muscles proximaux avec neuropathie périphérique.
Toxicité neuropsychique, auditive, gustative
Les APS peuvent être responsables de manifestations neuro- psychiques banales comme une insomnie, des céphalées (1 % d’une grande série avec CQ ou HCQ), des bourdonnements d’oreille, une anxiété, une irritabilité, des cauchemars. Le mécanisme est encore inconnu même si plusieurs hypothèses physiopathologiques ont été proposées : déséquilibre de la balance cholinergique, antagonisme des prostaglandines, hyperréactivité dopaminergique.
Cinq cas de toxicité cochléaire à l’HCQ ont été rapportés dans la littérature. Il s’agit d’une surdité de perception avec altération de l’audiogramme et des potentiels évoqués auditifs. La rareté de cette toxicité ne justifie pas la pratique régulière de potentiels évoqués auditifs.
Les dysgueusies après prise d’HCQ sont encore plus exceptionnelles.
En conclusion
Malgré la multiplicité des effets secondaires, l’HCQ est, dans l’ensemble, bien tolérée à condition d’adapter le rythme de la surveillance oculaire aux facteurs de risque. Les sujets maigres sont souvent surdosés, d’où la nécessité d’une surveillance oculaire plus étroite.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :