Publié le 05 sep 2006Lecture 14 min
Dermatite atopique : la fonction barrière et ses anomalies
Y. Gall, CHU La Grave, Toulouse
La dermatite atopique (DA) est une affection préoccupante dans les sociétés développées par l’accroissement régulier de sa prévalence depuis 30 ans. En moyenne, chez les enfants de la naissance à 7 ans, celle-ci est passée de 5,3 % en 1964 à 12 % en 1989 et 15 % en 2002. C’est au Danemark que les chiffres seraient les plus élevés : 23 %. La DA touche en moyenne 1,3 fille pour 1 garçon.
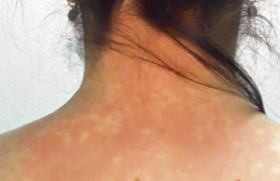
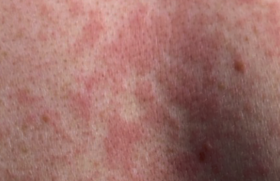
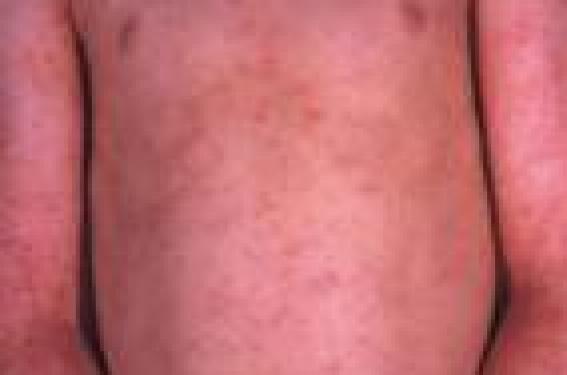
Le stratum corneum représente un empilement de cellules aplaties de 1 à 2 m d’épaisseur remplies de kératine et entourées d’une enveloppe cornée riche en ponts disulfures et en liaisons covalentes très stables. Dépourvues de noyau et d’organites, ces cellules ont un métabolisme réduit et assurent, en association avec une multicouche lipidique intercellulaire, la fonction barrière. La fonction barrière joue un rôle clé dans la physiopathologie de la DA. Elle explique l’impact des facteurs aggravants (détergents, eau chaude, etc.), les tendances évolutives liées à l’environnement (saisons, froid, vent, etc.) et justifie les approches thérapeutiques basées sur les émollients. On peut classer les différentes anomalies de la fonction barrière en anomalies cliniques, biologiques et immunologiques, biométrologiques et biochimiques, enfin en anomalies des systèmes de défense de surface. Ces anomalies s’associent à des degrés variables selon les périodes de la vie et selon les phases de la maladie. Fonction barrière et anomalies cliniques Plusieurs constatations cliniques évoquent des modifications de la fonction barrière au cours de la DA(1). La DA débute en général au cours des premières semaines de la vie : à ce stade, le prurit est constant et la xérose très fréquente de même que les lésions de grattage. À 2 ans, la DA atteint surtout les plis et les extrémités où la peau est souvent lichénifiée et fissurée, siège d’un prurit persistant. Dans un grand nombre de cas, la DA disparaît à l’adolescence, mais si elle persiste, xérose et lichénification sont constantes (figures 1 et 2). Figure 1. Lésions diffuses et prurigineuses de dermatite atopique (Service du Dr Viraben, hôpital La Grave, Toulouse). Figure 2. Lésions lichénifiées et fissurées sur peau atopique (Service du Dr Viraben, hôpital La Grave, Toulouse). Dans 35 % des cas, une ichtyose vulgaire est associée à la DA. Elle s’observe notamment sur les jambes et va persister toute la vie (figure 3). Figure 3. Ichtyose vulgaire chez un atopique (Service du Dr Viraben, hôpital La Grave, Toulouse). D’autres signes cliniques évoquent une anomalie de la fonction barrière : • La peau sèche est retrouvée dans plus de 50 % des DA et semble aggravée par l’accroissement des habitudes d’hygiène et la baisse de l’humidité ambiante dans des atmosphères surchauffées ou confinées. • La sudation s’accompagne souvent de prurit chez l’atopique. Les sels contenus dans la sueur stimulent les terminaisons nerveuses de l’épiderme du fait de la perméabilité de la barrière. • La laine, l’eau chaude, les matières synthétiques sont fréquemment mal tolérées. • La peau des sujets atopiques est sensible à certains facteurs irritatifs comme les savons, l’eau de piscine, les polluants. • La dermatose plantaire juvénile est, peut-être, le résultat d’une sensibilisation accrue à la sueur et aux frottements. • Le pityriasis alba (zones achromiques sèches notamment du visage et des membres) apparaît en hiver et reste en général marqué en été après le bronzage. • La kératose pilaire, classique sur la face externe des bras, la face antérieure des cuisses ou le visage, est associée dans 30 % des cas à la DA. • Les eczémas de contact (figure 4) sont fréquents aux allergènes de l’environnement (poussières de maison, pollens, etc.) et aux molécules en contact avec la peau (bijoux, parfums, etc.). • La région péribuccale est parfois sèche et fissurée. Une desquamation chronique des lèvres accompagne une perlèche commissurale. Figure 4. Eczéma de contact à un antiseptique utilisé après épilation chez une atopique (Service du Dr Viraben, hôpital La Grave, Toulouse). La peau sèche et ses signes d’accompagnement, ainsi que la grande sensibilité de la peau atopique aux irritants sont autant de signes qui évoquent cliniquement une anomalie de la fonction barrière. Fonction barrière et anomalies biologiques et immunologiques Les cellules de l’épiderme sont impliquées dans les désordres immunitaires de la DA. Les anomalies de la fonction barrière facilitent la pénétration des allergènes environnementaux et contribuent à la dysrégulation du système immunitaire cutané lors de sa mise en place et de son fonctionnement(2). l Le kératinocyte Première cellule en contact avec l’environnement, il agit à la fois sur : – la cellule de Langerhans par l’intermédiaire de chémokines comme MIP3 (Macrophage Inflammatory Protein 3) ; – l’éosinophile via certaines interleukines (IL8, IL16) et des chémokines ; – le lymphocyte via d’autres chémokines comme TARC (Thymus and Activation Related Chemokine). Celle-ci est exprimée dans les kératinocytes basaux au niveau de la peau lésionnelle. Les chémokines sont de petites protéines contenant des résidus cystéine qui contrôlent les migrations leucocytaires. l Le lymphocyte Le lymphocyte, issu de la maturation type TH2, exprime des cytokines pro-inflammatoires (IL4, IL5, IL10, IL13) alors que les molécules comme IL2 (qui assure la régulation de l’inflammation) et INFg (qui joue un rôle anti-infectieux) font défaut. La plupart des cytokines sécrétées par les lymphocytes TH2 inhibent la différenciation type TH1 entraînant un phénomène d’auto-amplification. l La cellule de Langerhans Elle exprime MDC (Macrophage Derivated Chemokine) et sécrète IL6 après liaison avec le récepteur de haute affinité des IgE. Ce sont de puissants chimio-attractants pour les éosinophiles, les lymphocytes et les cellules dendritiques. Dans la peau atopique, du fait des anomalies de la fonction barrière, les grosses molécules d’allergènes appelées atopènes (poussières de maison, pollens, poils d’animaux, pneumallergènes, etc.) pénètrent en grande quantité et se lient aux cellules présentatrices d’antigènes grâce à leur forte concentration en récepteurs aux IgE. Cette pénétration est facilitée par l’activité protéasique propre de ces atopènes. L’expression des récepteurs aux IgE à la surface des cellules dendritiques varie en fonction de l’environnement où se trouvent les cellules. Elle est très élevée dans la peau atopique lésionnelle. Ainsi, les trois types cellulaires (kératinocyte, lymphocyte et cellule de Langerhans) induisent, dans la peau atopique, des réactions en cascade via chémokines et interleukines pour aboutir à une réaction d’hypersensibilité retardée aux allergènes de l’environnement. Les anomalies de la fonction barrière contribuent à la fois à la période de sensibilisation et à la phase de déclenchement de l’eczéma. Fonction barrière et anomalies biométrologiques Une seule méthode permet d’évaluer la fonction barrière : il s’agit de la mesure de la perte insensible en eau (PIE)(3). Celle-ci peut se faire en valeur basale ou après occlusion pour mesurer la capacité du stratum corneum à retenir l’eau. D’autres méthodes comme la mesure d’hydratation permettent d’évaluer le niveau de sécheresse de la peau. Associées aux échelles de quantification de la gravité de la DA, ces mesures permettent une évaluation globale des différents paramètres de l’affection. Dans tous les cas, ces techniques nécessitent des conditions rigoureuses : température de la pièce comprise entre 20 et 22 °C, hygrométrie entre 50 et 55 %, temps de repos pour le patient avant la mesure de 15 à 20 minutes. Mesure de la perte insensible en eau Elle fait appel à deux types d’appareils : l’un dit « à chambre ouverte » comme l’évaporimètre (Servomed Ep-3) ou Tewametre (Courage et Khazaka) (figure 5) l’autre dit « à chambre fermée » comme l’Aquaflux (Biox-Systems ). Figure 5. Évaporimètre pour la mesure de la perte insensible en eau. Le gradient de vapeur d’eau (dm/dt) est proportionnel au gradient de pression (dp/dx) à la surface de la peau. Les mesures sont répétées pendant 15 minutes et moyennées. Les valeurs exprimées en g/m2/h sont plus élevées dans la peau atopique y compris en peau saine, ce qui témoigne d’une anomalie intrinsèque de la fonction barrière (tableau 1). Test de sorption-désorption Un patch-test occlusif est appliqué pendant 24 heures sur l’avant-bras en peau normale. Après retrait du patch, la peau est essuyée délicatement et des mesures de PIE répétées pendant 25 minutes. La PIE est plus faible en peau saine atopique (figure 6). Cela témoigne d’une incapacité de la peau atopique à retenir l’eau et explique le risque d’eczéma de contact. Figure 6. Valeurs de PIE lors d’un test de sorption-désorption en peau saine (sujet sain) en peau psoriasique (*) et en peau atopique (n) (E. Berardesca(3)). Mesure de l’hydratation cutanée Plusieurs techniques sont disponibles faisant appel soit à la conductivité thermique du stratum corneum, soit à ses propriétés élastiques, soit encore à ses propriétés diélectriques. Un des appareils les plus utilisés (figure 7) est le Cornéomètre (Courage et Khazaka) qui fournit des résultats en unités internationales. La mesure de la conductivité se fait par passage d’un courant électrique entre les deux pôles concentriques de la sonde. La capacitance est proportionnelle à la résistance et à l’impédance qui dépendent elle-mêmes de la quantité d’eau présente dans le stratum corneum. Figure 7. Cornéomètre pour la mesure de l’hydratation. La peau atopique en apparence saine est plus sèche que la peau normale d’un sujet sain (tableau 2). Cela contraste avec la spongiose qui caractérise la peau atopique en histologie (figure 8). Figure 8. Histologie de peau atopique révélant la spongiose (Service du Dr Viraben, hôpital La Grave, Toulouse). Score d’évaluation clinique et biométrologique De nombreuses échelles d’évaluation ont été mises au point pour quantifier l’importance de la DA(4) : – SCORAD (Severity Scoring of Atopic Dermatitis) qui associe des mesures de surface atteinte (règle des 9), des paramètres cliniques (intensité de l’érythème, des excoriations, de la lichénification, de la sécheresse cutanée, etc.) et des critères subjectifs (perte de sommeil, prurit ) ; – EASI (Eczema Area and Severity Index) qui ne tient pas compte de certains paramètres cliniques comme la xérose ni des paramètres subjectifs comme le prurit ou les troubles du sommeil ; – Un nouveau système de cotation associe les paramètres cliniques et biométrologiques : OSAAD (Objective Severity Assessment of Atopic Dermatitis Score). Il comprend une mesure des surfaces atteintes qui sont reportées sur un schéma et scannérisées (figure 9). Figure 9. Dessins permettant de calculer les surfaces corporelles atteintes (B) et au sein de celle-ci les zones très atteintes (C). Le couplage aux mesures d’hydratation et d’évaporimétrie permet de calculer un indice global (J.L. Sugarman(4)). On distingue les surfaces très atteintes, peu atteintes et normales. Sur ces différentes zones corporelles, on mesure la capacitance (hydratation) et la PIE. L’index est obtenu en multipliant les différentes surfaces atteintes par leurs valeurs respectives d’hydratation et de PIE. Cette technique est la plus complète car elle relie paramètres cliniques et mesures biométrologiques, mais elle est lourde à mettre en place. Fonction barrière et anomalies biochimiques P. Elias a comparé le stratum corneum (SC) à un mur de briques où les kératinocytes forment les blocs et les espaces lipidiques intercornéocytaires, le béton. Cet ensemble, hydrophobe, est l’objet d’un processus évolutif de la profondeur vers la surface. Au niveau de la jonction stratum granulosum (SG) et stratum corneum les kératinocytes commencent à perdre leurs organites en libérant les corps d’Odland alors que les espaces intercellulaires sont hydrophiles et riches en lipides polaires comme les glucocéramides, le cholestérol sulfate et les sphingolipides. Au niveau des couches superficielles du stratum corneum, les cornéocytes sont remplis de kératohyaline et les espaces intercellulaires sont hydrophobes et imperméables grâce aux céramides et aux acides gras libres à longue chaîne. Ces processus sont altérés à plusieurs niveaux dans la peau atopique. Anomalies de la libération des corps d’Odland Les corps lamellaires (CL) sont des vésicules intracytoplasmiques bien individualisées au niveau du stratum granulosum et renfermant à la fois des enzymes et de grosses molécules lipidiques. Une étude ultrastructurale(5) à partir de punch biopsies a comparé les CL en termes de : – nombre et volume de CL sur deux couches de kératinocytes de la partie supérieure du stratum granulosum ; – nombre de CL intra- ou extracytoplasmiques au niveau de la jonction stratum corneum-stratum granulosum. Une mesure de la PIE a été faite en peau saine non atopique et en peau atopique confirmant des valeurs plus élevées en peau atopique (8,6 g/m2/h) qu’en peau saine (5,4 g/m2/h). Les résultats (figure 10) montrent que : – le nombre de CL fusionnés avec la membrane des kératinocytes du SG est beaucoup plus faible (13 %) en peau atopique qu’en peau saine (42 %) ; – le nombre de CL intracytoplasmiques est plus élevé en peau atopique (26 %) qu’en peau saine (8 %). On retrouve quelques corps lamellaires dans la partie basse du SC en peau atopique, ce qui n’est pas le cas en peau saine. Ces travaux montrent une anomalie de l’extrusion des CL dans la DA, perturbant le processus de transformation des lipides polaires à partir de la jonction SG-SC et un décalage de l’activité des hydrolases. Figure 10. Coupes semi-fines examinées en microscopie électronique de la jonction stratum granulosum/stratum corneum comparant la libération des corps d’Odland en peau saine (a) et en peau atopique (b). En (a) les corps lamellaires sont fusionnés à la membrane cellulaire et en (b) ils sont encore intracytoplasmiques. En (c) on note la persistance des corps d’Odland dans le stratum corneum (M. Fartasch(5)). Anomalies du taux des céramides À partir de prélèvements par biopsie de surface utilisant une colle type cyanoacrylate, il est possible d’arracher successivement 5 couches de cellules cornées puis de pratiquer une extraction des lipides à l’hexane éthanol et de doser les différents lipides par chromatographie en couche mince(6). En comparant la peau de 65 sujets sans atopie à 35 sujets atopiques (tableau 3), on note : – une baisse du taux des lipides totaux, – une augmentation du rapport céramides totaux sur lipides totaux, – une chute du taux des céramides surtout 1 et 3. Le SC est composé de 30 % d’eau dont 20 % sont liés à la kératine et 10 % aux lipides intercellulaires. Les céramides sont des lipides amphiphiles et leur baisse en peau atopique explique l’incapacité de la DA à retenir l’eau transépidermique. Anomalies des voies enzymatiques catalytiques Utilisant les mêmes techniques que précédemment, un premier groupe d’auteurs(7) a montré que les activités glucocérébrosidases étaient comparables en peau saine et en peau atopique, mais avec une augmentation des activités céramidases. D’autres auteurs ont montré plus tard que les activités sphingomyélines hydrolases étaient accrues en peau atopique avec accumulation d’un composé anormal, la sphingosyl phosphoryl choline (figure 11). La comparaison du taux de cet enzyme en peau atopique et en peau saine confirme des taux 17 fois plus élevé en peau atopique. Figure 11. Principales voies métaboliques intervenant dans la synthèse et la dégradation des céramides dans la DA (M. Ishibashi(7)). Fonction barrière et anomalies des systèmes de défense Il existe à la surface de la peau des peptides antibactériens appelés défensines dont le but est d’empêcher la colonisation bactérienne de la surface cutanée. L’une d’entre elles est la sphingosine, issue du métabolisme final des céramides : son taux(8) est abaissé dans la DA. Cela expliquerait en partie la colonisation par Staphylococcus aureus. Il existe une corrélation entre le taux de céramidase acide et le taux de sphingosine dans la peau de la DA. Par ailleurs, le manteau acide de la surface cutanée est constitué par les acides gras libres, le film hydrolipidique et les sécrétions sudorales. Le pH normal du SC est de 4,5 à 5,3 en surface et de 6,8 en profondeur. Il est augmenté dans la peau atopique(9) que la peau soit atteinte ou saine. Ces facteurs contribuent à la sensibilité de la peau atopique aux infections bactériennes (S. aureus) ou virales (Molluscum contagiosum). Conclusion La physiopathologie de la DA garde une part de mystère (atopia = étrange). S’agit-il d’une affection dysimmunitaire ou auto-immunitaire ? Les anomalies de la fonction barrière sont-elles le primum movens ou la conséquence des troubles immunitaires sous- jacents ? Les avancées physiopathologiques ont mis en évidence dans les couches superficielles de l’épiderme un déficit en céramides et en sphingosine ainsi qu’une déviation métabolique aboutissant à l’accumulation d’un composé anormal, la sphingosyl phosphoryl choline. Il en résulte des anomalies de la qualité de la barrière (sécheresse et accroissement de la PIE) et un trouble des systèmes de défenses cutanés. Cependant, la question posée par le Pr A. Kligman : Is dry skin dry ? reste d’actualité. La peau atopique est sèche car elle semble incapable de retenir l’eau du flux transépidermique. Il faudrait réussir à corriger de façon durable les troubles de la fonction barrière.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :