Publié le 16 fév 2022Lecture 8 min
Tumeurs cutanées associées aux papillomavirus humains
François AUBIN, Service de dermatologie, CHRU de Besançon, Université de Franche-Comté, Inserm
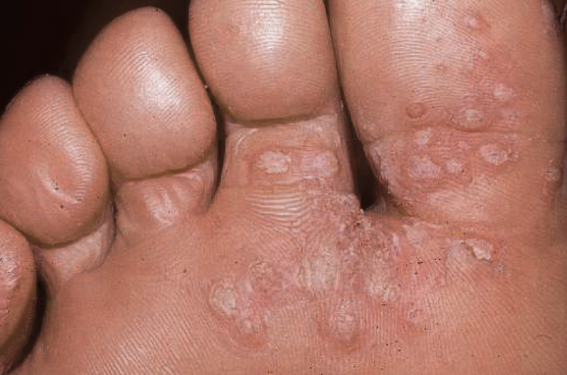
Chez l’homme, plus de 200 types de papillomavirus (HPV) ont été répertoriés. Ils sont regroupés en genres et en espèces en fonction des identités de séquence nucléotidique de leur génome(1).
En pratique clinique, le tropisme tissulaire permet de distinguer les papillomavirus (HPV) cutanés, quasiment exclusivement répartis dans les genres bêta (HPV 5, par exemple), gamma (HPV 4) et mu (HPV 1), et les HPV muqueux (HPV 6, 11, 16, et 18) appartenant majoritairement au genre alpha. On notera cependant que les HPV associés aux verrues vulgaires (types 2, 3, 4, 27 et 57) appartiennent aussi au genre alpha. Par ailleurs, en fonction de leur potentiel oncogène, les HPV cutanés ou muqueux sont volontiers qualifiés de haut risque ou oncogènes (HPV 5, 8, 16, 18, 31, 33, 38, 45, 52, 58) ou de bas risque ou non-oncogènes (HPV 1, 2, 3, 4, 6, 7, 10, 11, 27, 57).
Histoire naturelle de l'infection à HPV
L’infection cutanée par HPV survient dès la naissance puisque la prévalence de l’ADN de HPV beta à la surface cutanée est de 55 à 70 % entre la naissance et 4 ans. Cette prévalence est similaire à celle observée chez les mères et les autres adultes proches. La prévalence de l’ADN de HPV chez les adultes varie entre 50 et plus de 90 % selon les études, les populations étudiées et les techniques de détection utilisées.
Toutes les études s’accordent sur un portage très fréquent d’ADN à HPV au niveau cutané, suggérant que les HPV cutanés font partie de la flore microbienne cutanée(1). La signification biologique de cette flore virale n’est pas connue, mais elle pourrait participer à l’homéostasie tolérogène de la peau. Les HPV infectent exclusivement les cellules épithéliales de la peau et des muqueuses, soit par contact directement avec un épithélium infecté, soit à partir de virions présents dans les squames épithéliales et libérées dans l’environnement. Plusieurs études suggèrent l’existence d’un réservoir viral au sein des cellules souches épithéliales, cutanées ou muqueuses. Dans la peau, les follicules pileux, en particulier la zone renflée du bulbe (bulge), pourraient constituer le réservoir des HPV et être à l’origine des rechutes observées après traitement.
Pour qu’il y ait infection virale, il est nécessaire que les particules virales pénètrent profondément dans l’épithélium pour infecter les cellules de la couche basale épithéliale, dont certaines sont capables de se diviser. Cette pénétration est vraisemblablement favorisée par les microtraumatismes épidermiques ou par des altérations de la barrière cutanée ou via le follicule pileux. L’ADN viral est ensuite libéré dans le cytoplasme puis transporté sous forme circulaire épisomale dans le noyau de la cellule établissant une infection latente. La phase de latence virale s’accompagne d’une faible transcription et traduction protéique, à l’origine d’une immunosurveillance efficace. L’infection latente peut aussi succéder à une infection virale productive contrôlée par une réponse immunitaire efficace(2,3).
Si la majorité des infections à HPV sont éliminées par une réponse immunitaire humorale et cellulaire efficace, les HPV ont aussi développé différentes stratégies d’échappement immunitaire expliquant les infections persistantes. En particulier, l’infection épithéliale par les HPV peut s’accompagner d’une inhibition de la réponse immunitaire innée ou adaptative(3).
Les mécanismes de réactivation virale sont mal connus, mais ils sont probablement liés à une rupture du contrôle immunitaire et à une activation cellulaire. S’ensuit alors une infection productive, à l’origine de lésions papillomateuses cutanées ou muqueuses et d’une production de virions : le cycle viral est étroitement lié à la différenciation des cellules hôtes au cours de leur ascension dans l’épithélium. Les virions sont ensuite libérés dans le milieu extérieur par la desquamation des kératinocytes superficiels. Cette libération épithéliale superficielle contribue à l’absence de virémie, et s’effectue sans cytolyse expliquant l’absence de réaction inflammatoire et donc de réponse immunitaire antivirale efficace.
Dans certains cas, une intégration aléatoire du génome viral peut s’opérer dans le génome cellulaire, notamment pour les HPV muqueux alpha à haut risque, et déclencher le processus de carcinogenèse avec l’hyperexpression des oncoprotéines virales E6 et E7 conduisant entre autres à l’inactivation respective des 2 suppresseurs de tumeurs p53 et pRB(3).
Tumeurs cutanées bénignes à HPV : les verrues
Lésions cutanées bénignes dont la prolifération est induite par les HPV, les verrues se différencient les unes des autres par leur aspect clinique, par leur localisation anatomique (figures 1-6) et par le type de HPV responsable de la lésion (tableau 1). La charge virale est élevée au sein des lésions, favorisant leur contagiosité. Le diagnostic est clinique et ne justifie habituellement pas de biopsie ni de recherche d’ADN viral. La régression spontanée est habituelle en plusieurs mois ou années, avec souvent une guérison simultanée de verrues réparties sur différents endroits du corps. Néanmoins, certaines verrues plantaires peuvent persister des années, notamment chez l’adulte.
Les verrues peuvent exister à tous les âges, mais elles affectent plus particulièrement les enfants de 10 à 16 ans, en particulier s’il existe déjà des verrues dans l’entourage familial ou scolaire. Van Haalen et coll(4) ont montré qu’un tiers des enfants de 4 à12 ans ont des verrues des mains ou des pieds. La prévalence et le nombre de types viraux présents sont plus élevés chez les sujets immunodéprimés, notamment les patients greffés d’organe. La transmission de(s) HPV responsable(s) de la lésion se fait par contact direct ou indirect, à travers une effraction cutanée. La transmission des HPV cutanés par contact indirect avec des surfaces contaminées (sol de gymnase, piscine) ou par auto-inoculation a été récemment remise en question . En raison de l’absence d’enveloppe, les HPV (à la différence des virus enveloppés tels que le VIH ou le HSV) sont relativement résistants aux détergents.
Infections cutanées à papillomavirus et déficit immunitaire acquis et génétique (tableau 2)
Il s’agit de lésions cutanées bénignes classiques (verrues, papillomes, lésions verruco-kératosiques) mais volontiers profuses (figure 7) et survenant sur les régions photo-exposées.
Des éruptions cutanées simulant une épidermodysplasie verruciforme (figure 8) sont parfois observées au cours de l’infection par le VIH ou des lymphopénies CD4 idiopathiques. À la différence des populations immunocompétentes, ces verrues régressent rarement, sont souvent récalcitrantes aux traitements de première intention. Le nombre de types viraux présents dans les follicules pileux des patients immunodéprimés ainsi que la charge virale est significativement plus élevé que chez les sujets immunocompétents et pourrait contribuer au risque de cancer cutané chez ces patients.
Chez les patients transplantés d’organe, le contrôle des verrues profuses peut passer par une baisse des doses d’immunosuppresseurs ou par une substitution thérapeutique, notamment pour le sirolimus, inhibiteur de la protéine mTOR, à la place de la ciclosporine ou du tacrolimus(5). Les rétinoïdes à faibles doses peuvent aussi être efficaces à la fois sur les lésions bénignes et sur la prévention des cancers épidermoïdes cutanés.
Traitements des verrues (tableau 3)
Il n’existe pas, à l’heure actuelle, de thérapie antivirale spécifique dirigée contre les HPV infectant la peau et les muqueuses. Les méthodes thérapeutiques fré-quemment utilisées ont globalement toutes le même taux de guérison ou de récurrence. Les traitements de référence demeurent la cryothérapie et l’application d’acide salicylique. Les objectifs thérapeutiques sont soit de détruire ou d’enlever les lésions visibles, soit d’avoir un effet cytotoxique direct sur les cellules infectées. Aucun de ces traitements ne peut éradiquer définitivement l’infection à HPV ou permettre une parfaite protection contre la récurrence.
Les HPV font partie du microbiome cutané, et les infections cutanées latentes à HPV peuvent en effet conduire à des récurrences très tardives. Dans la mesure où la majeure partie des infections cutanées à HPV sont limitées et peuvent être spontanément éliminées, les différents traitements entrepris ne doivent pas laisser de cicatrices ou d’autres séquelles. De ce fait, une attitude observationnelle seule peut être une alternative envisageable pour les lésions strictement cutanées.
La revue Cochrane(6) retenait en première ligne de traitement l’acide salicylique, montrant sa supériorité significative par rapport au placebo, en particulier sur les verrues des mains. La cryothérapie forte serait plus efficace que la douce, à défaut de ses effets indésirables, mais la cryothérapie en général n’aurait pas montré de différence significative par rapport au placebo, sauf pour les verrues palmaires. L’association d’azote liquide et d’acide salicylique semblait par ailleurs plus efficace.La vaccination anti-HPV nonavalente pourrait être efficace en curatif ou en prévention des récidives(7). Son évaluation est en cours dans un essai français.
Infections à HPV, lésions cutanéo-muqueuses cancéreuses et précancéreuses
De nombreux travaux ont mis en évidence la présence d’ADN de HPV dans une forte proportion de lésions précancéreuses (kératoses actiniques) et de cancers épithéliaux cutanés, en particulier les carcinomes épidermoïdes. L’infection cutanée par les HPV bêta joue un rôle uniquement dans les phases précoces de la carcinogenèse cutanée en favorisant les effets mutagènes des radiations ultraviolettes. Les oncoprotéines virales E6 et E7 interfèrent avec de nombreuses fonctions cellulaires et inhibent l’apoptose, la réparation de l’ADN, la réponse immunitaire et la différenciation cellulaire(3,8). Puis,les kératinocytes exposés aux UV vont accumuler les lésions mutagènes de l’ADN et progressivement se transformer de façon indépendante à la présence virale (figure 9).
Curieusement, les carcinomes épidermoïdes invasifs et in situ (maladie de Bowen, figure 10) des extrémités digitales ne sont pas infectés par des HPV bêta mais le plus souvent par le HPV16 du genre alpha (muqueux à haut risque oncogène). On retrouve fréquemment un portage associé des mêmes types de HPV au niveau génital, suggérant une transmission manuportée. Les mécanismes expliquant le tropisme digital de ces types d’HPV ne sont pas connus.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :