Publié le 29 fév 2024Lecture 3 min
Absence d’efficacité de l’ustékinumab dans la polymyosite et la dermatomyosite - Résultat d’un essai contrôlé randomisé de phase III
François CHASSET, service de dermatologie et allergologie, hôpital Tenon, Paris
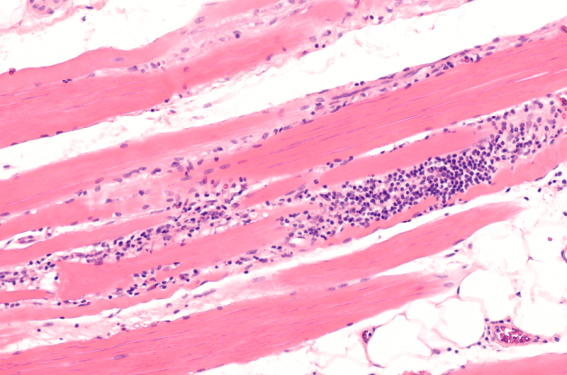
La polymyosite et la dermatomyosite sont les représentantes principales du groupe des myopathies inflammatoires. Ces maladies inflammatoires chroniques sont caractérisées par une atteinte et une faiblesse des muscles proximaux et touchent différents organes, en particulier pour la dermatomyosite, comme le cœur, les poumons, le tube digestif...
Les traitements de la polymyosite (PM) et de la dermatomyosite (DM) sont mal codifiés et incluent la corticothérapie générale en première intention, associée à des immu-nosuppresseurs classiques (méthotrexate, mycophénolate mofétil, tacrolimus, azathioprine), des immunoglobulines intraveineuses et des biothérapies, en particulier le rituximab. Les anti-JAK ont montré des résultats intéressants récemment. Des données murines et in vitro ont montré un rôle important des cytokines pro-inflammatoires IL-12 et IL-23. Ces cytokines sont inhibées par l’ustékinumab qui est un Ac monoclonal IgG1 kappa inhibant la sous unité p-40 commune à l’IL-12 et à l’IL-23 qui est utilisé dans le psoriasis, le rhumatisme psoriasique, la maladie de Crohn.
Dans cette étude, les auteurs rapportent les données d’efficacité de l’ustékinumab dans un essai de phase 3 japonais dans la PM et la DM. Il s’agissait d’une étude de phase 3, multicentrique, incluant des patients diagnostiqués avec une PM/DM active, qui n’avaient pas répondu de manière adéquate à un ou plusieurs traitements standards. Les patients ont été randomisés 1:1 pour recevoir de l’ustékinumab (n = 25) ou un placebo (n = 26). Les participants ont reçu une administration intraveineuse d’ustékinumab basée sur leur poids corporel (6 mg/kg) ou un placebo à la semaine 0, suivie d’une administration sous-cutanée (SC) d’UST ou d’un placebo de 90 mg toutes les 8 semaines, de la semaine 8 à la semaine 24. Il s’agissait d’une étude cross-over. À la semaine 24, le groupe placebo recevait l’ustékinumab selon le même schéma, et, par la suite, tous les participants recevaient de l’ustékinumab 90 mg toutes les 8 semaines (de la semaine 32 à la semaine 72). Le critère d’évaluation principal de l’efficacité était la proportion de participants ayant atteint une amélioration minimale (≥ 20) dans le score total d’amélioration de l’Évaluation de la Myosite Internationale et des Études Cliniques (IMACS TIS) à la semaine 24.
La dose de corticoïde, le PGA et la qualité de vie ainsi que la tolérance étaient également évaluées.
Au total, 51 patients ont été randomisés, 25 dans le groupe ustékinumab, 26 dans le groupe placebo. En ce qui concerne le critère de jugement principal, l’amélioration de > 20 du score IMACS TIS à la semaine 24, il n’existait pas de différence significative dans les 2 groupes : 64,0 % dans le groupe ustékinumab, 61,5 % dans le groupe placebo. Il existait un signal pour une amélioration dans le groupe des dermatomyosites : 66,7 % d’amélioration dans le groupe ustékinumab versus 46,7 % dans le groupe placebo p = 0,34, mais un signal inverse était observé dans le groupe des PM. Il existait quelques signaux encourageants sur des critères secondaires (ininterprétables car le critère de jugement principal n’est pas atteint), avec une amélioration supérieure de l’atteinte musculaire de l’abduction des épaules, p = 0,02 et une amélioration du score PGA à la limite de la significativité (p = 0,07). La tolérance globale était bonne, néanmoins on notait davantage d’effet indésirable dans le groupe ustékinumab 92 % versus 69,2 % et davantage d’effets indésirables sévères 20 % versus 3,8 %. Les effets indésirables sévères observés sous ustékinumab étaient le zona n = 2, une diverticulose sigmoïdienne, une ostéonécrose et une insuffisance respiratoire aiguë.
Au total, cet essai de phase 3 montre l’absence d’efficacité de l’ustékinumab dans la dermatomyosite et la polymyosite. À noter le faible nombre d’inclusions et la population hétérogène. Enfin, pour le dermatologue, il faut pointer l’absence d’utilisation du CDASI qui évalue spécifiquement l’atteinte cutanée dans la dermatomyosite. Au vu de ces données, l’ustékinumab ne doit pas être utilisé dans la dermatomyosite.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :